题目内容
19.可逆反应在一定条件下达到化学平衡状态的标志是( )| A. | 反应停止了 | B. | 正反应速率与逆反应速率相等 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率均为零 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.可逆反应达到平衡状态时,正逆反应速率相等但不等于0,是一个动态平衡状态,故A错误;
B.可逆反应达到平衡状态时,正逆反应速率相等但不等于0,是一个动态平衡状态,故B正确;
C.反应达到平衡状态时,反应物和生成物浓度不一定相等,与反应物初始浓度及转化率有关,故C错误;
D.可逆反应达到平衡状态时,正逆反应速率相等但不等于0,是一个动态平衡状态,故D错误;
故选B.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,否则不能作为判断依据,注意平衡状态时正逆反应速率相等但不是0.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
9.如图所示,是由碳棒、铁片和氯化铜溶液组成的原电池,下列叙述正确的是( )


| A. | 碳棒为正极 | |
| B. | 碳棒上的电极反应式为2H2O+O2+4e-═4OH- | |
| C. | 铁片上的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 铁片为阴极 |
10.橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如图,选项中关于橙花醇的叙述,错误的是( )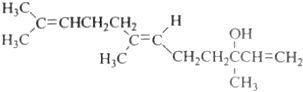

| A. | 橙花醇的分子式C15H26O | |
| B. | 橙花醇在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 橙花醇既能发生取代反应,也能发生加成反应和氧化反应 | |
| D. | 1mol 橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
7.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g),经过一段时间后达到平衡.反应过程中测定的t/s-n(PCl3)/mol数据如图.下列说法正确的是( )

| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| C. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% |
14.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA | |
| B. | 常温常压下,18.00克重水(D2O)中所含电子数约为10NA | |
| C. | 在熔融状态下1molNaHSO4所含阳离子数为2NA | |
| D. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
11.向盛有白糖的小烧杯中加几滴水搅拌均匀,在滴入浓硫酸,白糖变黑,并迅速膨大,俗称“黑面包”,同时又气体逸出,若将该气体通入澄清石灰水中,有白色沉淀生成,下列叙述中不正确的是( )
| A. | 浓硫酸的作用,脱水剂、强氧化剂 | B. | “黑面包”的主要成分:C | ||
| C. | 气体的主要成分:SO2、CO2 | D. | 白色沉淀只有CaCO3 |
8.在一定条件下,将分別盛有熔融氯化钾、氯化镁、氧化铝的三个电解槽串联、通电、电解,一段时间后,得到钾、镁、铝的物质的量之比为( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
9. 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Al、Fe、Mg.
(2)甲同学的实验目的是探究探究反应物本身的性质对反应速率的影响.
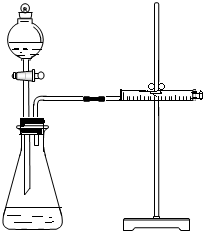
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定同一金属与浓度不同但体积相同的硫酸产生一定体积的气体所需要的时间于(或在一定时间内产生气体的体积).
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
 影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:
影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究.他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素.甲同学的实验报告如下表:| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
(2)甲同学的实验目的是探究探究反应物本身的性质对反应速率的影响.
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验.
(3)乙同学在实验中应该测定的数据是测定同一金属与浓度不同但体积相同的硫酸产生一定体积的气体所需要的时间于(或在一定时间内产生气体的体积).
(4)乙同学完成实验应选用的实验药品是Mg(或Fe)和 0.5mol/L、2mol/L的硫酸.
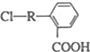 (其中R为饱和烃基),X在一定条件下如图所示的转化关系,已知Q的蒸气密度是相同条件下H2密度的74倍,分子组成符号CaHbO2
(其中R为饱和烃基),X在一定条件下如图所示的转化关系,已知Q的蒸气密度是相同条件下H2密度的74倍,分子组成符号CaHbO2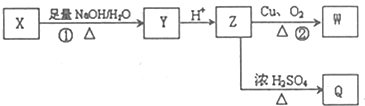
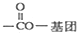 ),写出任意一种能发生银镜反应的符合上述条件的物质的结构简式
),写出任意一种能发生银镜反应的符合上述条件的物质的结构简式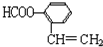
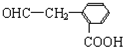 .于由X通过一步反应得到P,该反应的化学方程式是
.于由X通过一步反应得到P,该反应的化学方程式是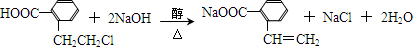
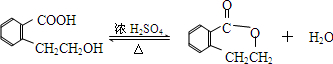 .
.