题目内容
7.C1、C2、α1、α2、pH1、pH2分别表示2种一元弱酸的物质的量浓度、电离度和溶液的pH.如果已知pH1>pH2,且α1>α2,则C1和C2的关系是( )| A. | C1>C2 | B. | C1=C2 | C. | C1<C2 | D. | 无法确定 |
分析 因都是一元弱酸,则由pH可知酸电离生成的氢离子的浓度,由电离度可知电离的程度,再利用浓度与电离度的关系来分析解答.
解答 解:已知pH1>pH2,则酸2电离生成的氢离子的浓度大,即C1×α1<C2×α2,
已知α1>α2,
则C1<C2可使上式成立,
故选C.
点评 本题较难理解,考查学生对酸的电离及电离度的分析,明确cα=c(H+)是解答本题的关键,注意讨论来分析解答问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.在下列各溶液中,粒子一定能大量共存的是( )
| A. | 可以使甲基橙变红的溶液中:Fe3+、Al3+、Cl-、H2O2 | |
| B. | 由水电离产生的H+浓度为1×10-13mol•L-1的溶液中,Na+、K+、Cl-、HCO3- | |
| C. | 强碱性的溶液中:CO32-、Na+、[Al(OH)4]-、NO3- | |
| D. | 酸性溶液中:Fe3+、Al3+、NO3-、C6H5O- |
11.下列化学用语表示正确的是( )
| A. | Cl-的结构示意图: | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氢氧化钠的电子式: | D. | 铁元素不属于主族元素 |

 (1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.



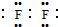 ;若Y为化合物,用石墨电极电解Y的水溶液,其电解反应为2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑.
;若Y为化合物,用石墨电极电解Y的水溶液,其电解反应为2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑.