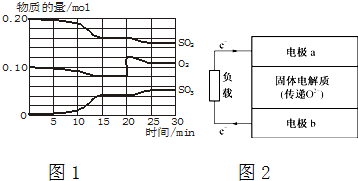
题目内容
19.在下列各溶液中,粒子一定能大量共存的是( )| A. | 可以使甲基橙变红的溶液中:Fe3+、Al3+、Cl-、H2O2 | |
| B. | 由水电离产生的H+浓度为1×10-13mol•L-1的溶液中,Na+、K+、Cl-、HCO3- | |
| C. | 强碱性的溶液中:CO32-、Na+、[Al(OH)4]-、NO3- | |
| D. | 酸性溶液中:Fe3+、Al3+、NO3-、C6H5O- |
分析 A.使甲基橙变红的溶液为酸性溶液,铁离子能够促进双氧水的分解;
B.由水电离产生的H+浓度为1×10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子能够与氢离子、氢氧根离子反应;
C.强碱性溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.铁离子、铝离子能够与C6H5O-发生双水解反应,C6H5O-与酸性溶液中的氢离子结合生成苯酚,硝酸根离子在酸性条件下能够氧化苯酚.
解答 解:A.使甲基橙变红的溶液中存在大量氢离子,H2O2不稳定,在Fe3+的催化作用下能够分解,不能大量共存,故A错误;
B.由水电离产生的H+浓度为1×10-13mol•L-1的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,HCO3-能够与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.CO32-、Na+、[Al(OH)4]-、NO3-之间不发生反应,都不与强碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.Fe3+、Al3+能够与C6H5O-发生双水解反应,C6H5O-与酸性溶液中的氢离子结合生成C6H5OH,NO3-在酸性条件下具有强氧化性,能够氧化苯酚,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
9.下列关于常见物质的工业冶炼说法正确的是( )
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业制溴:某些植物有富集溴的能力,从海产品中提取溴是工业上获取溴的重要途径 | |
| C. | 冶炼铝:电解Al2O3,同时加入冰晶石(Na3AlF6),目的是为了降低Al2O3熔融温度 | |
| D. | 硫酸工业:在氧气充足的情况下,从接触室进入吸收塔的气体中不可能含有SO2 |
10.下列装置或操作能达到目的是( )
| A. | 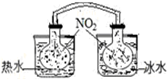 依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 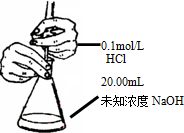 测定锥形瓶内的NaOH的浓度 | |
| C. | 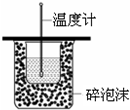 测定中和热 | |
| D. | 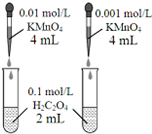 依据褪色快慢比较浓度对反应速率的影响 |
7.C1、C2、α1、α2、pH1、pH2分别表示2种一元弱酸的物质的量浓度、电离度和溶液的pH.如果已知pH1>pH2,且α1>α2,则C1和C2的关系是( )
| A. | C1>C2 | B. | C1=C2 | C. | C1<C2 | D. | 无法确定 |
14.在含有硝酸铜、硝酸镁、硝酸银的溶液中加入适量锌粉,首先置换出的是( )
| A. | Mg | B. | Cu | C. | Ag | D. | H2 |


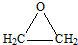 .
.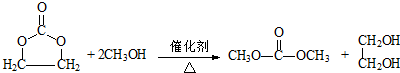 .
.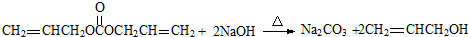 .
. .
. ;③C、D形成的化合物的电子式
;③C、D形成的化合物的电子式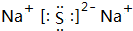 ;
;