题目内容
17.在1.01×105Pa时,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则H2的燃烧热为286KJ/mol;表示氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol.分析 燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;根据n=$\frac{m}{M}$计算1mol氢气完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式.
解答 解:4g氢气的物质的量为:n=$\frac{m}{M}$=$\frac{4g}{2g/mol}$=2mol,2molH2在O2中完全燃烧生成2.00mol液态H2O放出572kJ的热量,所以1mol氢气完全燃烧放出热量286KJ,氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol;H2的燃烧热为286KJ/mol,
故答案为:286KJ/mol;H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol.
点评 本题考查了热化学方程式的书写原则和方法应用,燃烧热概念的分析判断,热化学方程式的计算应用,题目较简单.

练习册系列答案
相关题目
7.以NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA | |
| B. | 0.1mol Na2SO4溶液中,含有SO42-数为0.1NA | |
| C. | 46gNO2和N2O4混合气体中,含有氧原子总数为3NA | |
| D. | 0.5L 1mol/LNaCl溶液中含有的钠离子浓度1mol/L |
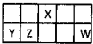
8. Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出X的原子结构示意图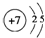 .
.
(2)Y、Z、W的简单离子半径由大到小顺序为S2->Cl->Al3+(用离子符号表示).
(3)含Y的某种盐常用作净水剂,其净水原理是Al3+3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示).
Ⅱ.运用所学化学原理,解决下列问题:
(4)已知:①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=2CO(g)+Si(s)△H=(a+b-c)kJ•mol-1.
(5)已知:CO(g)+H2O(g)?H2(g)+CO2(g).表为该反应在不同温度时的平衡常数.该反应的△H<0(填“>”、“<”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为75%.
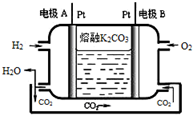
(6)以熔融K2CO3为电解质的一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
 Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出X的原子结构示意图
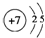 .
.(2)Y、Z、W的简单离子半径由大到小顺序为S2->Cl->Al3+(用离子符号表示).
(3)含Y的某种盐常用作净水剂,其净水原理是Al3+3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示).
Ⅱ.运用所学化学原理,解决下列问题:
(4)已知:①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=2CO(g)+Si(s)△H=(a+b-c)kJ•mol-1.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(6)以熔融K2CO3为电解质的一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
12.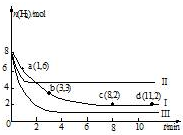 一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:
一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:
CO2(g)+3H2?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线I所示.下列说法正确的是( )
 一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:
一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:CO2(g)+3H2?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线I所示.下列说法正确的是( )
| A. | 该反应在0~8min内CO2的平均反应速率是0.375mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3molCO2和4molH2,则平衡时H2的条件分数大于20% | |
| C. | 若起始是向上述容器中充入4molCO2、2molH2、2molCH3OH和1molH2O(g),则此是反应向正反应方向进行 | |
| D. | 改变条件得到曲线II、III,则曲线II、III改变的他分别是升高温度、充入氢气 |
9.下列关于常见物质的工业冶炼说法正确的是( )
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业制溴:某些植物有富集溴的能力,从海产品中提取溴是工业上获取溴的重要途径 | |
| C. | 冶炼铝:电解Al2O3,同时加入冰晶石(Na3AlF6),目的是为了降低Al2O3熔融温度 | |
| D. | 硫酸工业:在氧气充足的情况下,从接触室进入吸收塔的气体中不可能含有SO2 |
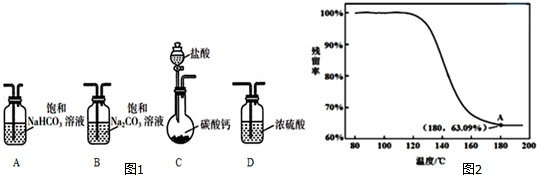
6.某学习小组利用图1装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3.
(1)选取必要的实验装置,正确的连接顺序为CAB(填序号).
(2)为确定制得的固体样品是纯净的NaHCO3,小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案不可行(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
(i)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[己知:0.l mol•L-1 NaHCO3溶液电离出的c(CO32-)为0.001l mol•L-1,Ksp(BaCO3)=5.1×10-9]
答:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
(ii)产生浑浊(伴有气体产生)的离子方程式Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是制得的固体样品是纯净的NaHCO3.
(残留率=$\frac{剩余固体的质量}{原始固体的质量}$×100%)
(1)选取必要的实验装置,正确的连接顺序为CAB(填序号).

(2)为确定制得的固体样品是纯净的NaHCO3,小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案不可行(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
[己知:0.l mol•L-1 NaHCO3溶液电离出的c(CO32-)为0.001l mol•L-1,Ksp(BaCO3)=5.1×10-9]
答:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
(ii)产生浑浊(伴有气体产生)的离子方程式Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是制得的固体样品是纯净的NaHCO3.
(残留率=$\frac{剩余固体的质量}{原始固体的质量}$×100%)
7.C1、C2、α1、α2、pH1、pH2分别表示2种一元弱酸的物质的量浓度、电离度和溶液的pH.如果已知pH1>pH2,且α1>α2,则C1和C2的关系是( )
| A. | C1>C2 | B. | C1=C2 | C. | C1<C2 | D. | 无法确定 |
 .
.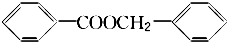 .
.