题目内容
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)制备精细化工产品PbSO4·3PbO·H2O(三盐)的主要流程如下:
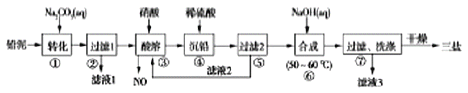
已知:常温下,Ksp(PbSO4)≈1.0×10-8,Ksp(PbSO4)≈1.0×10-13
回答下列问题:
(1)铅蓄电池在生活中有广泛应用,其工作原理是:Pb+PbO+2H2SO4![]() 2PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为__________。若铅蓄电池放电前,正、负极质量相等,放若电时转移了lmol电子,则理论上两电极质量之差为_____________。
2PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为__________。若铅蓄电池放电前,正、负极质量相等,放若电时转移了lmol电子,则理论上两电极质量之差为_____________。
(2)将滤液1、滤液3合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(Mr=322),其化学式为________________。
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO的离子方程式为________________;滤液2中溶质的主要成分为_____________(写化学式)。
(4)步骤⑥合成三盐的化学方程式为______________。
(5)步骤⑦洗涤的操作是________________________________。
(6)在步骤①的转化中,若硫酸铅和碳酸铅在浊液中共存,则![]() =________。
=________。
【答案】 PbSO4+2H2O-2e-=PbO2+SO42-+4H+ 16g Na2SO4·10H2O 3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O HNO3 4PbSO4+6NaOH![]() PbSO4·3PbO·H2O↓+3Na2SO4+2H2O 沿玻璃棒继续向漏斗中加入蒸馏水至刚好浸没沉淀,待水自然流下后重复操作2~3次 2.0×105
PbSO4·3PbO·H2O↓+3Na2SO4+2H2O 沿玻璃棒继续向漏斗中加入蒸馏水至刚好浸没沉淀,待水自然流下后重复操作2~3次 2.0×105
【解析】(1)铅蓄电池在充电时,阳极上发生氧化反应,电极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+ ;放电时,正极的电极反应式为PbO2+2e-+ SO42-+4H+![]() PbSO4+2H2O;负极的电极反应式为Pb-2e-+ SO42-
PbSO4+2H2O;负极的电极反应式为Pb-2e-+ SO42-![]() PbSO4;若转移2mol电子,则正极材料净增质量为m(PbSO4)-m(PbO2);负极材料净增质量为m(PbSO4)-m(Pb),两极质量之差为m(O2)=32 g。所以,放电时转移1mol电子,两极质量之差为16 g;正确答案:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ ; 16g。
PbSO4;若转移2mol电子,则正极材料净增质量为m(PbSO4)-m(PbO2);负极材料净增质量为m(PbSO4)-m(Pb),两极质量之差为m(O2)=32 g。所以,放电时转移1mol电子,两极质量之差为16 g;正确答案:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ ; 16g。
(2)滤液Ⅰ和滤液Ⅲ中的主要溶质是Na2SO4,由相对分子质量Mr=322知,析出的结晶水合物为Na2SO4·10H2O;正确答案:Na2SO4·10H2O 。
(3)铅与硝酸反应类似铜与硝酸反应,铅与硝酸反应的离子方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O ;沉铅涉及的反应为Pb(NO3)2+H2SO4![]() PbSO4↓+2HNO3,所以滤液Ⅱ中的溶质主要是HNO3;正确答案:3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;HNO3。
PbSO4↓+2HNO3,所以滤液Ⅱ中的溶质主要是HNO3;正确答案:3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;HNO3。
(4)硫酸铅与NaOH溶液加热反应,合成三盐的化学方程式为4PbSO4+6NaOH![]() 3PbO·PbSO4·H2O↓+3Na2SO4+2H2O;正确答案:4PbSO4+6NaOH
3PbO·PbSO4·H2O↓+3Na2SO4+2H2O;正确答案:4PbSO4+6NaOH![]() PbSO4·3PbO·H2O↓+3Na2SO4+2H2O。
PbSO4·3PbO·H2O↓+3Na2SO4+2H2O。
(5) 对沉淀进行洗涤的操作为:沿玻璃棒继续向漏斗中加入蒸馏水至刚好浸没沉淀,待水自然流下后重复操作2~3次;正确答案:沿玻璃棒继续向漏斗中加入蒸馏水至刚好浸没沉淀,待水自然流下后重复操作2~3次。
(6)PbSO4(s)+CO32-(aq)![]() PbCO3(s)+ SO42-(aq),K=
PbCO3(s)+ SO42-(aq),K=![]() = Ksp(PbSO4)/Ksp(PbCO3)=2×10-8/10-13=2.0×105;正确答案:2.0×105。
= Ksp(PbSO4)/Ksp(PbCO3)=2×10-8/10-13=2.0×105;正确答案:2.0×105。

 阅读快车系列答案
阅读快车系列答案