题目内容
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
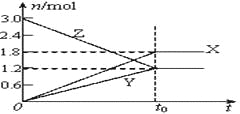
A. 该反应的化学方程式为:3X+2Y![]() 2Z
2Z
B. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
C. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
【答案】C
【解析】试题分析:A、根据图,Z是反应物,X、Y是生成物,化学反应速率之比等于化学计量数之比,即为(3-1.2):1.8:1.2=3:3:2,3Z![]() 3X+2Y,故错误;B、此反应正向是物质的量增大,恒容状态下,物质的量增大,压强增大,反应速率加快,恒压下,浓度减小,反应速率变慢,因此达到平衡时所需的时间大于t0,故错误;C、Z的物质的量分数相同,属于等效平衡,即Y为固态或液态,故正确;D、升高温度,气体膨胀,体积增大,不能说明此反应是吸热还是放热反应,故错误。
3X+2Y,故错误;B、此反应正向是物质的量增大,恒容状态下,物质的量增大,压强增大,反应速率加快,恒压下,浓度减小,反应速率变慢,因此达到平衡时所需的时间大于t0,故错误;C、Z的物质的量分数相同,属于等效平衡,即Y为固态或液态,故正确;D、升高温度,气体膨胀,体积增大,不能说明此反应是吸热还是放热反应,故错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
