题目内容
【题目】Ⅰ、目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
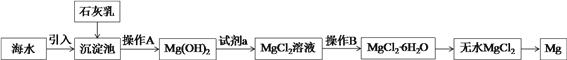
操作A是____________,下列仪器中操作B必须使用的有__________(填字母符号)。
A、锥形瓶 B、玻璃棒 C、表面皿 D、蒸发皿 E、坩埚
Ⅱ、乙醇镁[(CH3CH2O)2Mg] 为白色固体,难溶于乙醚和烃类,略溶于乙醇,在空气中会水解,常用作烯烃聚合催化剂载体和制备精密陶瓷的原料。某小组同学用镁粉(受潮会发生自燃、自爆)与乙醇在实验室中制备乙醇镁:
(1)干燥管中盛装的试剂为_____________,其作用为__________________________。
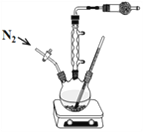
(2)下列操作的合理顺序为:______________。
a、将干燥的氮气通入装置,连续操作数次;
b、称取镁粉,量取无水乙醇加入反应器内;
c、加热回流,控制温度在80℃,反应1小时;
d、开启冷凝水和磁力搅拌器。
(3)将温度控制在80℃的原因是________________,写出生成乙醇镁的化学方程式____________________________。
(4)请你设计实验证明有乙醇镁生成(简述实验的方法):_______________________。
【答案】 过滤 BD 无水CaCl2 防止空气中的水蒸气进入装置中 badc 加快反应速率,减少反应物的挥发 Mg+2CH3CH2OH→(CH3CH2O)2Mg+H2↑ 取少量产品,加足量水充分振荡,加入少量酸性高锰酸钾溶液,高锰酸钾溶液褪色则说明有乙醇镁存在
【解析】分析:本题考查从海水中提取Mg、乙醇镁的制备和乙醇镁的检验。
I.在沉淀池中石灰乳与海水中Mg2+反应形成Mg(OH)2沉淀,经过滤分离出Mg(OH)2;Mg(OH)2中加入盐酸获得MgCl2溶液;从MgCl2溶液中获得MgCl2·6H2O的操作为:蒸发浓缩、冷却结晶;MgCl2·6H2O在HCl气流中加热失去结晶水获得无水MgCl2;电解熔融MgCl2制得Mg。
II.由镁粉与乙醇制备乙醇镁的原理为2CH3CH2OH+Mg→(CH3CH2O)2Mg+H2↑。
(1)由于乙醇镁在空气中会水解,为防止外界空气中的水蒸气进入装置中,干燥管中盛装的试剂为无水CaCl2。
(2)实验装置组装完毕,检查装置的气密性,向装置中加入试剂。由于镁粉受潮会发生自燃、自爆,乙醇镁在空气中会水解,所以实验前先通入干燥的N2排尽装置中空气;由于乙醇易挥发,球形冷凝管的作用是冷凝回流,为了提高乙醇的利用率,加热回流前要开启冷凝水和磁力搅拌器;操作的合理顺序为badc。
(3)实验温度控制在80℃的原因是:加快反应速率,减少乙醇的挥发。
(4)乙醇镁会水解,乙醇镁水解的方程式为(CH3CH2O)2Mg+2H2O→2CH3CH2OH+Mg(OH)2,要检验有乙醇镁生成只要检验水解产物中有乙醇生成。
详解:I. 在沉淀池中石灰乳与海水中Mg2+反应形成Mg(OH)2沉淀,从沉淀池中分离出Mg(OH)2的操作A是过滤。Mg(OH)2中加入盐酸获得MgCl2溶液;从MgCl2溶液中获得MgCl2·6H2O的操作B为:蒸发浓缩、冷却结晶,操作B必须使用的仪器有酒精灯、蒸发皿、玻璃棒、铁架台(含铁圈),答案选BD。
II. 乙醇中官能团为羟基,镁粉与乙醇制备乙醇镁的原理为2CH3CH2OH+Mg→(CH3CH2O)2Mg+H2↑。
(1)由于乙醇镁在空气中会水解,为防止外界空气中的水蒸气进入装置中,干燥管中盛装的试剂为无水CaCl2。其作用是防止空气中的水蒸气进入装置中。
(2)实验装置组装完毕,检查装置的气密性,向装置中加入试剂。由于镁粉受潮会发生自燃、自爆,乙醇镁在空气中会水解,所以实验前先通入干燥的N2排尽装置中空气;由于乙醇易挥发,球形冷凝管的作用是冷凝回流,为了提高乙醇的利用率,加热回流前要开启冷凝水和磁力搅拌器;操作的合理顺序为badc。
(3)实验温度控制在80℃的原因是:加快反应速率,减少反应物乙醇的挥发。生成乙醇镁的化学方程式为:2CH3CH2OH+Mg→(CH3CH2O)2Mg+H2↑。
(4)乙醇镁会水解,乙醇镁水解的方程式为(CH3CH2O)2Mg+2H2O→2CH3CH2OH+Mg(OH)2,要检验有乙醇镁生成只要检验水解产物中有乙醇生成。实验方法为:取少量产品,加足量水充分振荡,加入少量酸性高锰酸钾溶液,高锰酸钾溶液褪色则说明有乙醇镁存在。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案