题目内容
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2xH2O的化学方程式为______________________________。
(2)检验TiO2xH2O中Cl-是否被除净的方法是______________________________。
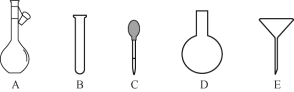
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是__________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的__________(填字母代号)。
(4)滴定终点的判定现象是________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗cmol/LNH4Fe(SO4)2 标准溶液VmL,则TiO2质量分数表达式为______________________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”“偏低”或“无影响”)。
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果__________。
【答案】 TiCl4+(2+x)H2O=TiO2·xH2O↓+4HCl 取少量水洗液,滴加![]() 溶液,不产生白色沉淀,说明
溶液,不产生白色沉淀,说明![]() 已除净 抑制
已除净 抑制![]() 水解
水解 ![]() 溶液变成红色
溶液变成红色 ![]() (或
(或![]() ) 偏高 偏低
) 偏高 偏低
【解析】本题考查化学工艺流程以及实验方案设计与评价,(1)按照水解的定义,TiCl4水解的反应方程式为TiCl4+(2+x)H2O=TiO2·xH2O↓+4HCl;(2)检验Cl-应用硝酸酸化的硝酸银,如果出现白色沉淀,说明没有洗净,如果没有出现白色沉淀,则说明已洗净,具体操作是:取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已经除净;(3)NH4+水解:NH4++H2O![]() NH3·H2O+H+,Fe3+水解:Fe3++3H2O
NH3·H2O+H+,Fe3+水解:Fe3++3H2O![]() Fe(OH)3+3H+,因此加入硫酸的目的是抑制NH4Fe(SO4)2的水解;还需要用到容量瓶和胶头滴管,即AC正确;(4)根据要求是Fe3+把Ti3+氧化成Ti4+,本身被还原成Fe2+,因此滴定终点的现象是溶液变为(血)红色;(5)根据得失电子数目守恒,有n(Ti3+)×1=n[NH4Fe(SO4)2]×1=V×10-3×c×1,根据元素守恒n(TiO2)=n(Ti3+)=V×10-3×cmol,即TiO2的质量分数为
Fe(OH)3+3H+,因此加入硫酸的目的是抑制NH4Fe(SO4)2的水解;还需要用到容量瓶和胶头滴管,即AC正确;(4)根据要求是Fe3+把Ti3+氧化成Ti4+,本身被还原成Fe2+,因此滴定终点的现象是溶液变为(血)红色;(5)根据得失电子数目守恒,有n(Ti3+)×1=n[NH4Fe(SO4)2]×1=V×10-3×c×1,根据元素守恒n(TiO2)=n(Ti3+)=V×10-3×cmol,即TiO2的质量分数为![]() (或
(或![]() ) ;(6)①配制标准液时,液体少量溅出,造成所配溶液的浓度偏低,在滴定实验中,消耗标准液的体积增大,即所测质量分数偏高;②滴定终点时,俯视刻度线,读出的消耗标准液的体积偏小,即所测质量分数偏低。
) ;(6)①配制标准液时,液体少量溅出,造成所配溶液的浓度偏低,在滴定实验中,消耗标准液的体积增大,即所测质量分数偏高;②滴定终点时,俯视刻度线,读出的消耗标准液的体积偏小,即所测质量分数偏低。

【题目】下列实验操作正确且能达到相应目的的是
选项 | 实验目的 | 实验操作 |
A | 称取2.0gNaOH固体 | 先在托盘上各放1张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
B | 配制稀硫酸 | 先将浓硫酸加入烧杯,后倒入蒸馏水 |
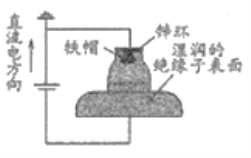
C | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
D | 检验溶液中是否有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
A. A B. B C. C D. D