题目内容
【题目】已知T℃时AgCl的Ksp=2×1010;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
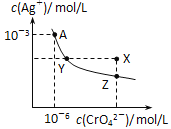
A. T℃时Ag2CrO4的Ksp=1×108
B. Y和Z点Ag2CrO4的Ksp不相同
C. 在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点
D. 浓度均为2×106molL﹣1AgNO3与NaCl溶液等体积混合无沉淀生成
【答案】D
【解析】
A.曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶解平衡为Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq),则Ksp=c2(Ag+)·c(CrO42-)=(10-3)2×10-6=10-12,A项错误;
2Ag+(aq)+CrO42-(aq),则Ksp=c2(Ag+)·c(CrO42-)=(10-3)2×10-6=10-12,A项错误;
B.Ag2CrO4的Ksp只与温度有关,Y和Z点温度相同,则Ksp相同,B项错误;
C.在饱和Ag2CrO4溶液中加入K2CrO4固体仍为饱和溶液,点仍在曲线上,所以不能使溶液由Y点变为X点,C项错误;
D.浓度均为2×10-6molL﹣1AgNO3与NaCl溶液等体积混合后,Qc(AgCl)=1×10-6×1×10-6=1×10-12<Ksp(AgCl),没有沉淀生成,D项正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
容器 | 温度/℃ | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
Ⅱ | 758 | 0.1 | 0.05 | 0 | |
Ⅲ | 858 | 0.2 | 0.1 | 0 | |
A. 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol·L-1·s-1
B. 平衡时,容器Ⅱ中SO3的浓度小于0.022mol·L-1
C. 平衡时,容器Ⅲ中SO3的浓度大于0.044mol·L-1
D. 若起始时,向容器Ⅰ中充入0.02mol SO2、0.01mol O2和0.02mol SO3,则反应向逆反应方向进行
【题目】常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液②NaOH溶液③CH3COONa溶液④Na2CO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH由大到小的顺序是_______(填序号)。
(2)NaCN溶液显碱性的原因(用方程式说明)______
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____④(填“>”、“<"、“=”)。
(4)25℃时,将amol·L-1 的醋酸和 0.1 mol·L-lNaOH溶液等体积混合后,溶液的pH=7,则a_____0.1(填“﹥”、“﹤”或“=”)。
(5)Na2CO3溶液中离子浓度大小为:___________
(6)向NaCN溶液中通入CH3COOH,则发生的离子反应方程式为:_______。
(7)同温下,溶液的pH值④____①(填“>”、“<"、“=”)。
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
序号 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br > I |
A. AB. BC. CD. D