题目内容
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
序号 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br > I |
A. AB. BC. CD. D
【答案】C
【解析】
A.Na、Mg位于同周期,金属性Na>Mg,则与冷水反应,Na比Mg剧烈,故A正确;
B.Ca、Mg位于同主族,金属性Ca>Mg,对应的最高价氧化物的水化物碱性为Ca(OH)2强于Mg(OH)2,故B正确;
C.SO2与NaHCO3溶液反应生成CO2,可知酸性亚硫酸大于碳酸,亚硫酸不是最高价氧化物的水化物,则不能以此比较非金属性,故C错误;
D.K越大,说明生成的气态氢化物越稳定,则稳定性为HBr>HI,则非金属性为Br>I,故D正确;
答案选C。

【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态O原子的电子排布图为_______,基态O原子电子占据最高能级的电子云轮廓图为____形,O原子最外层电子的运动状态有_____种。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______________。
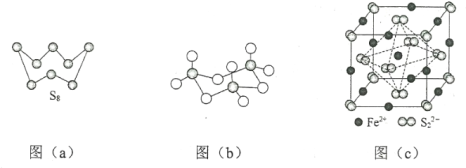
(3)图(a)为S8的结构,该分子中S原子的杂化轨道类型为______________。其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____________。
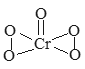
(4)气态三氧化硫以单分子形式存在,其分子中共价键的类型有_______种(根据成键的方式);固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的价层电子数___________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞中有Fe2+_____个,有S22-_____个,晶胞中Fe2+位于S22-所形成的_____的体心。
(6)酸性H2SO4 __________H2SO3(填 “>”或 “<”)。