��Ŀ����
����Ŀ�������£���Ũ�Ⱦ�Ϊ0.1 mol��L-l������4����Һ����NaCN��Һ��NaOH��Һ��CH3COONa��Һ��Na2CO3��Һ
HCN | H2CO3 | CH3COOH |
Ka=4.9��10-10 | Ka1=4��10-7 Ka2=5.6��10-11 | Ka=1.7��10-5 |
��1����4����ҺpH�ɴ�С��˳����_______������ţ���
��2��NaCN��Һ�Լ��Ե�ԭ���÷���ʽ˵����______
��3�����������Ģۺ͢��еμ������������ԣ�����������������_____�ܣ�����>������<"����=������
��4��25��ʱ����amol��L-1 �Ĵ���� 0.1 mol��L-lNaOH��Һ�������Ϻ���Һ��pH=7����a_____0.1����������������������=������
��5��Na2CO3��Һ������Ũ�ȴ�СΪ��___________
��6����NaCN��Һ��ͨ��CH3COOH�����������ӷ�Ӧ����ʽΪ��_______��
��7��ͬ���£���Һ��pHֵ��____�٣�����>������<"����=������
���𰸡���>��>��>�� CN- +H2O![]() HCN +OH- < �� c(Na+)>c(CO32��)>c(OH��)>c(HCO3��)>c(H+) CH3COOH+ CN- =HCN+CH3COO- >
HCN +OH- < �� c(Na+)>c(CO32��)>c(OH��)>c(HCO3��)>c(H+) CH3COOH+ CN- =HCN+CH3COO- >
��������
��1����ϱ���������֪������ƽ�ⳣ��ԽС������Խ��������������ˮ�����Խ��Խˮ������������
��2����������ˮ����˭ǿ��˭����ԭ������ԭ��
��3��ͨ���ȽϢۺ͢���Һ�еļ���ǿ�����Աȴﵽ���Ժ����ĵ�ͬŨ�ȵ�����������
��4������Ϊ���ᣬǡ����ȫ�кͺ����ҺΪ�����ƣ�ˮ���Լ��ԣ��ݴ˷�����
��5��Na2CO3��Һ��CO32-�ᷢ��ˮ�⣬���ˮ��ƽ�������ƽ�������Һ������Ũ�ȴ�С��ϵ��
��6������ǿ��������ԭ����д��
��7���������Һ����Խ��Խˮ�������ɽ��
��1����ͬŨ�ȵ���Һ�У���NaCN��Һˮ���Լ��ԣ���NaOH��ҺΪǿ����Һ����CH3COONa��Һ�Լ��ԣ���Na2CO3��Һˮ���Լ��ԣ���Ϊ���ԣ����HCN��̼��������ӣ�Խ��Խˮ�⣬�����Һ�ļ��Ԣڣ��ܣ��٣��ۣ�4����ҺpH�ɴ�С��˳���Ǣڣ��ܣ��٣��ۣ�
�ʴ�Ϊ���ڣ��ܣ��٣��ۣ�
��2����NaCN��Һ�д���ˮ��ƽ��CN- +H2O![]() HCN +OH-���ٽ�ˮ�ĵ��룬ʹ��Һ�Լ��ԣ�
HCN +OH-���ٽ�ˮ�ĵ��룬ʹ��Һ�Լ��ԣ�
�ʴ�Ϊ��CN- +H2O![]() HCN +OH-��
HCN +OH-��
��3����Ũ�Ȣ�CH3COONa��Һ�͢�Na2CO3��Һ�У�����Խ��Խˮ����ɽ�ϱ�����Կ����������ԣ����̼��������ӣ����Ե�Ũ�ȵ�Na2CO3��Һˮ��̶ȴ���CH3COONa��ˮ��̶ȣ���Ӧ�ļ���ǿ��CH3COONa�������������Ģۺ͢��еμ������������ԣ�����������������<�ܣ�
�ʴ�Ϊ��<��
��4�������ΪһԪ���ᣬ�������������������ȫ�к����ɵĴ������Լ��ԣ��ֵ������Ϻ���Һ��pH=7��������������a��0.1��
�ʴ�Ϊ������
��5��Na2CO3��Һ�У�CO32-�ᷢ��ˮ�⣬��ˮ��ƽ��Ϊ��CO32- +H2O![]() HCO3- +OH-����Һ��ʾ���ԣ����ɵ�̼��������Ӳ��ַ���ˮ�⣬���ַ��������룬HCO3-
HCO3- +OH-����Һ��ʾ���ԣ����ɵ�̼��������Ӳ��ַ���ˮ�⣬���ַ��������룬HCO3-![]() H++ CO32-����Na2CO3��Һ������Ũ�ȴ�С��ϵΪ��c(Na+)>c(CO32��)>c(OH��)>c(HCO3��)>c(H+)��
H++ CO32-����Na2CO3��Һ������Ũ�ȴ�С��ϵΪ��c(Na+)>c(CO32��)>c(OH��)>c(HCO3��)>c(H+)��
�ʴ�Ϊ��c(Na+)>c(CO32��)>c(OH��)>c(HCO3��)>c(H+)��
��6��CH3COOH��Ka=1.7��10-5��HCN��Ka=4.9��10-10�������ǿ��������ԭ����֪����NaCN��Һ��ͨ��CH3COOH�����������ӷ���ʽΪ��CH3COOH+ CN- =HCN+CH3COO-��
�ʴ�Ϊ��CH3COOH+ CN- =HCN+CH3COO-��
��7����̼��ĵڶ�������ƽ�ⳣ��Ka2=5.6��10-11��HCN�ĵ���ƽ�ⳣ��Ka=4.9��10-10�������ԣ�HCN��̼��������ӣ����Զ�Ӧ����ˮ��̶ȣ�̼���ƣ�NaCN,��ͬ���£���Һ��pHֵ�ܩ��٣�
�ʴ�Ϊ��>��

����Ŀ����ҵ�Ͽ�������������װһ��װ�����ⶨ��������Ҫ�ɷ�FeS2���������������(����SO2��H2SO3�������ķ�Ӧ)��ʵ�����ȷ�����������£�
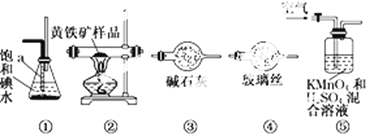
A�����Ӻ�װ�ã������װ�õ�������
B����ȡ��ϸ�Ļ�������Ʒ
C����2.0 g��ƷС�ĵط���Ӳ�ʲ�������
D����1 L/min�����ʹ������
E����Ӳ�ʲ������еĻ�������Ʒ���ȵ�800�桫850��
F����300 mL�ı��͵�ˮ����SO2�������ķ�Ӧ�ǣ�I2��SO2��2H2O = 2HI��H2SO4
G������Һ��CCl4��ȡ������
H��ȡ20.00mLG��������Һ����0.2000mol��L��1��NaOH����Һ�ζ����Իش�
��1������G��������Ҫ������______��Ӧȡ_______ (����������������)����Һ���к���ʵ�顣
��2��װ����ȷ������˳���� ![]()
![]()
![]() ��
�� ![]() (����)��______
(����)��______
��3��װ�â��и�����ص�������__________�������������������__________��
��4������H�еζ�ʱӦѡ��_____��ָʾ�������Ը���________�������жϵζ��Ѿ��ﵽ�յ㡣
��5���ٶ��������е����ڲ���E����ȫ��ת��ΪSO2�����ұ����͵�ˮ��ȫ���գ��ζ��õ����������±���ʾ��
�ζ����� | ����Һ�����/mL | NaOH����Һ�����/mL | |
�ζ�ǰ | �ζ��� | ||
��һ�� | 20.00 | 0.00 | 20.48 |
�ڶ��� | 20.00 | 0.22 | 20.20 |
������ | 20.00 | 0.36 | 20.38 |
���������Ʒ����Ԫ�ص���������Ϊ___________��
��6��Ҳ������������������������ⶨ�������к��������������������ַ����ⶨ���������װ�â���������Һ�м������������Լ�__________ ��
A.��������Һ B.�Ȼ�����Һ C.����ʯ��ˮ D.���Ը��������Һ
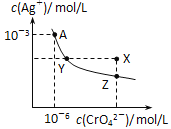
����Ŀ����ͼ�ý�����෨��ʾ��һЩ����֮��Ĺ�ϵ�����в���ȷ���ǣ� ��
X | Y | Z |
| |
A | ����ͭ | �� | ������ | |
B | ���������� | ���������� | ������ | |
C | ���������� | �ǽ��������� | ������ | |
D | ǿ����� | ����� | ������ |
A.AB.BC.CD.D