题目内容
【题目】钠及它们的化合物在生产、生活中有着重要的用途。
Ⅰ.碳酸氢钠可做安全气囊中的冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是___。
Ⅱ.高压钠灯发光效率高、穿透力强、耗电少,寿命长。这种灯发出的光为___色。
Ⅲ.过氧化钠是重要的工业漂白剂。某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。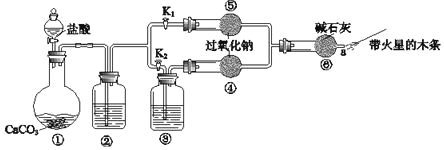
(1)(装置分析)
①装置①中反应的离子方程式是___。
②装置②中的试剂是___(填序号)。
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
③装置③中的试剂是___。
(2)(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
①步骤1和步骤2中,a处带火星的木条产生的实验现象分别是___。
②过氧化钠跟二氧化碳反应的化学方程式是__。
(3)(实验反思)
①有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是__。
②需要补充的实验操作是:取⑤中反应后的少量固体,___。
【答案】2NaHCO3![]() Na2CO3+H2O+CO2↑ 黄色 CaCO3+2H+=Ca2++H2O+CO2↑ a 浓硫酸 步骤1中木条不复燃,步骤2中木条复燃 2Na2O2+2CO2=2Na2CO3+O2 气体中有水,水也可与Na2O2反应产生O2使木条复燃 加入稀盐酸,将产生的气体通入澄清的石灰水中
Na2CO3+H2O+CO2↑ 黄色 CaCO3+2H+=Ca2++H2O+CO2↑ a 浓硫酸 步骤1中木条不复燃,步骤2中木条复燃 2Na2O2+2CO2=2Na2CO3+O2 气体中有水,水也可与Na2O2反应产生O2使木条复燃 加入稀盐酸,将产生的气体通入澄清的石灰水中
【解析】
Ⅰ.碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
Ⅱ.钠的焰色为黄色;
Ⅲ.(1)①碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;
②碳酸钙和盐酸反应的过程中会混有挥发出的HCl;
③装置③中盛放浓硫酸,用于干燥得到的CO2;
(2)①打开弹簧夹K2,关闭K1,生成少量氧气;打开弹簧夹K1,关闭K2,生成了较多的氧气;
②过氧化钠跟二氧化碳反应,生成碳酸钠和氧气;
(3)①CO2和H2O均可与过氧化钠反应;
②若要达到实验的目的,需要对产物进行检验,确定其中是否含有碳酸盐。
Ⅰ. 碳酸氢钠分解的方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
Ⅱ. 钠的焰色为黄色,因此高压钠灯发出的光为黄色;
Ⅲ.(1)①碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;
②碳酸钙和盐酸反应的过程中会混有挥发出的HCl,可用饱和的碳酸氢钠溶液吸收;
③装置③中盛放浓硫酸,用于干燥得到的CO2;
(2)①打开弹簧夹K2,关闭K1,干燥的CO2与过氧化钠反应,生成碳酸钠和少量氧气,a处木条无法复燃;打开弹簧夹K1,关闭K2,CO2、水与过氧化钠反应,生成了碳酸钠和较多的氧气,a处的木条可以复燃;
②过氧化钠跟二氧化碳反应,生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;
(3)①CO2和H2O均可与过氧化钠反应,气体中如有水,水也可与Na2O2反应产生O2使木条复燃;
②若要达到实验的目的,需要对产物进行检验,确定其中是否含有碳酸盐,方法为:加入稀盐酸,将产生的气体通入澄清的石灰水中,观察是否有浑浊生成。