题目内容
【题目】如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)。
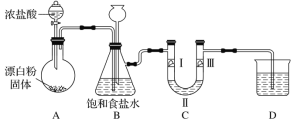
已知:装置A是氯气的发生装置,反应的化学方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。据此回答下列问题:
(1)装置B中饱和食盐水的作用是________;长颈漏斗的作用是__________。
(2)装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是: 湿润的有色布条、 无水氯化钙、干燥的有色布条,请你推测Ⅰ、Ⅲ处的现象依次为:______,_____。
(3)装置D的作用是___________,则烧杯中的溶液是______,写出所发生反应的化学方程式: ________。
【答案】除去Cl2中的HCl,降低Cl2在水中的溶解度 监测实验进行时装置C中是否发生堵塞 有色布条褪色 无变化 吸收多余的氯气,防止污染环境 浓NaOH溶液(合理即可) Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大;据监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大来分析;
(2)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(3) 据氯气有毒不能直接排放到空气中,应用碱吸收来分析。
(1)制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大,所以可以用B中饱和食盐水吸收氯气中的氯化氢;监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,气体将溶液压入长颈漏斗B中,形成水柱;
故答案为:除去Cl2中的HCl,降低Cl2在水中的溶解度;监测实验进行时装置C中是否发生堵塞;
(2)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,因为C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,
故答案:有色布条褪色;无变化;
(3)氯气有毒不能直接排放到空气中,故D的作用是吸收多余的氯气,防止污染空气,氯气是酸性气体,故用碱液NaOH溶液吸收,氯气与氢氧化钠反应生产氯化钠,次氯酸钠和水,反应为Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为: 吸收多余的氯气,防止污染环境;浓NaOH溶液(合理即可);Cl2+2NaOH=NaCl+NaClO+H2O。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态O原子的电子排布图为_______,基态O原子电子占据最高能级的电子云轮廓图为____形,O原子最外层电子的运动状态有_____种。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______________。
(3)图(a)为S8的结构,该分子中S原子的杂化轨道类型为______________。其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____________。
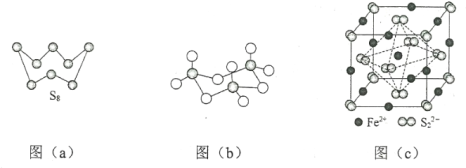
(4)气态三氧化硫以单分子形式存在,其分子中共价键的类型有_______种(根据成键的方式);固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的价层电子数___________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞中有Fe2+_____个,有S22-_____个,晶胞中Fe2+位于S22-所形成的_____的体心。
(6)酸性H2SO4 __________H2SO3(填 “>”或 “<”)。