题目内容
【题目】已知空气-锌电池的电极反应为:锌片:Zn+20H--2e-=ZnO+H20 石墨:02+2H20+4e-=40H-根据此判断,锌片是
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原、
【答案】A
【解析】
试题分析:根据化合价可知,电极反应中锌的化合价升高,被氧化,原电池中较活泼的金属做负极,发生氧化反应,则锌为原电池的负极,选A。

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
【题目】电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液。请按要求回答下列问题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:______________________________________,该过程中调节溶液的pH为5,则c(Fe3+)为:____________mol·L-1。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
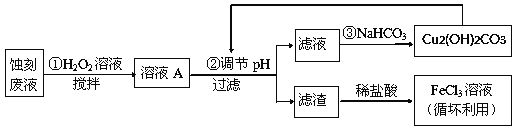
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:_______________。
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:_________________。
③步骤①中加入H2O2溶液的目的是:______________________________________。
④已知:生成氢氧化物沉淀的pH
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是:________________。
⑤写出步骤②中生成CO2的离子方程式:__________(已知Cu2(OH)2CO3难溶于水)。