题目内容
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
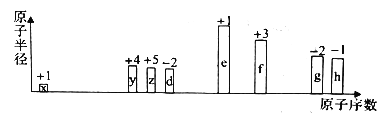
A. 离子半径的大小顺序:d
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
【答案】C
【解析】从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。A.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,故A错误;B.常温下,水为液体,甲烷、氨气为气体,水的沸点最高,氨气分子之间存在氢键,沸点高于甲烷,故B错误;C. 除去实验后试管中残留的硫单质,可用热的氢氧化钠溶液洗涤,反应的方程式为6NaOH+3S=2Na2S+Na2SO3+3H2O,故C正确;D. S、Cl的氧化物对应的水化物的酸性不一定满足h>g,如次氯酸为弱酸,硫酸为强酸,故D错误;故选C。

练习册系列答案
相关题目



