题目内容
【题目】实验室用粗铜(含杂质Fe)制备氯化铜。
(1)采用如下图所示的装置进行实验(部分仪器和夹持、加热装置已略去)。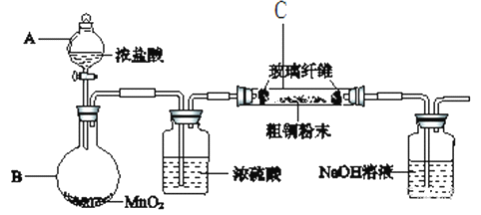
①仪器A的名称是________________;
②实验开始前,需要做的操作是____________________。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为______(填“是”或“否”)必需。原因_______________________________________。
④实验过程中,装置C内的现象是___________________________________。
⑤氢氧化钠溶液的作用是______________________________,其中发生反应的主要离子方程式___________________________、________________________。
(2)若将C中所得固体加稀硫酸溶解。取少量溶液于小试管中,滴加2滴KSCN溶液,无现象。请用必要的文字和离子方程式解释出现这一现象的原因_________________。
【答案】 分液漏斗 检验装置气密性 否 HCl对该反应无影响(或合理解释) 铜粉红热,产生棕黄色的烟,放出热量 吸收未反应的氯气和氯化氢气体,保护环境(或合理解释) Cl2+2OH-=Cl-+ClO-+H2O H++OH-=H2O 装置C中生成的氯化铁被未反应的铜还原成氯化亚铁,2Fe3++Cu=2Fe2++Cu2+
【解析】(1)①根据图示,仪器A为分液漏斗,故答案为:分液漏斗;
②该实验过程中涉及到气体的制备,因此实验开始前,需要进行的操作是检验装置气密性,故答案为:检验装置气密性;
③HCl对该反应无影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置,故答案为:否;HCl对该反应无影响;
④实验过程中,装置C中氯气与铜反应,铜粉红热,产生棕黄色的烟,放出热量,故答案为:铜粉红热,产生棕黄色的烟,放出热量;
⑤氯气和氯化氢会污染空气,因此需要用氢氧化钠溶液吸收未反应的氯气和氯化氢气体,其中发生反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O,故答案为:吸收未反应的氯气和氯化氢气体,防止污染环境;Cl2+2OH-=Cl-+ClO-+H2O;H++OH-=H2O;
(2)装置C中生成的氯化铁被未反应的铜还原成了氯化亚铁,2Fe3++Cu=2Fe2++Cu2+,因此滴加2滴KSCN溶液,无现象,故答案为:装置C中生成的氯化铁被未反应的铜还原成氯化亚铁,2Fe3++Cu=2Fe2++Cu2+。
