题目内容
19.下列有关说法正确的是( )| A. | Na2CO3和NaOH都能抑制水的电离 | |
| B. | 0.1 mol•L-1Na2CO3溶液加水稀释,CO32-的水解程度增大,溶液pH减小 | |
| C. | 酸碱中和滴定实验中,锥形瓶需用待测液润洗2~3次后,再加入待测液 | |
| D. | 常温下,pH=3的盐酸、醋酸分别用水稀释m倍、n倍后pH相同,则m<n |
分析 A.易水解的盐促进水的电离;
B.加水稀释水解程度增大;
C.中和滴定时锥形瓶不能润洗;
D.醋酸属于弱酸,pH相同时,醋酸溶液的浓度大,如稀释相同的倍数,则醋酸的PH小,若稀释后两溶液的pH仍相同,则m>n.
解答 解:A.易水解的盐促进水的电离,则Na2CO3水解时促进水的电离,NaOH能抑制水的电离,故A错误;
B.加水稀释水解程度增大,则0.1 mol•L-1Na2CO3溶液加水稀释,CO32-的水解程度增大,但是由于溶液比较变化大于氢氧根离子的变化,则溶液pH减小,故B正确;
C.中和滴定时锥形瓶不能润洗,若润洗,则锥形瓶中待测液的物质的量会偏大,滴定时消耗的标准溶液偏多,所以锥形瓶不能润洗,故C错误;
D.醋酸属于弱酸,pH相同时,醋酸溶液的浓度大,如稀释相同的倍数,则醋酸的PH小,若稀释后两溶液的pH仍相同,则m>n,故D正确.
故选BD.
点评 本题考查了盐的水解、水的电离的影响因素、中和滴定、弱电解质的电离,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.吸收能量的反应一定是( )
| A. | 贮存能量 | B. | 释放能量 | ||
| C. | 生成物稳定性大于反应物的稳定性 | D. | 原子得到电子的反应 |
7.在化学学习与研究中经常采用“推理”的思维方式,但有时也会得出错误的结论.下列“推理”正确的是( )
| A. | 较强酸可以制取较弱酸,推出H2S不能制取H2SO4 | |
| B. | 组成和结构相似的物质,沸点随相对分子质量增大而升高,推出SiH4沸点高于CH4 | |
| C. | 电解氯化铜溶液可得到Cu;则电解食盐水可以得到Na | |
| D. | 1mol O2和Mg完全反应获得4mol电子;则1mo1 O2和其他金属完全反应都获得4mol电子 |
14.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(H+)/c(OH-)=1012的溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| B. | pH=1的溶液中:K+、Fe2+、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO${\;}_{4}^{2-}$、SCN- | |
| D. | 与铝反应生成氢气的溶液中:NH${\;}_{4}^{+}$、K+、Cl-、SO${\;}_{4}^{2-}$ |
4.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D的单质中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F单质中燃烧,产物溶于水得到一种强酸.下列有关说法正确的是( )
| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | A与D元素所形成的化合物中只含极性键 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |
11.下列实验操作中,说法正确的是( )
| A. | 燃料电池的制作:用包有薄海绵的两根碳棒做电极电解Na2SO4溶液,一段时间后切断电源,在两极之间接上发光二极管,发现二极管发光 | |
| B. | 滴定管、移液管以及滴定过程中用于盛待测液的锥形瓶,使用前都需要洗涤与润洗 | |
| C. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| D. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 |
8.下列说法正确的是( )
| A. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| B. | 乙醇、乙烯、乙醛都能使酸性高锰酸钾溶液褪色 | |
| C. | 豆科作物根瘤菌将含氮化合物转化为蛋白质是氮的固定 | |
| D. | 核电站泄漏的放射性碘-131(${\;}_{53}^{131}$I)、铯-137(${\;}_{55}^{137}$Cs)互称同位素,可使蛋白质变性 |
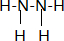 其中N的杂化轨道是sp3;联氨也有碱性,其碱性弱于氨 (填:强于、弱于);联氨的稳定性弱于氨(填:强于、弱于)
其中N的杂化轨道是sp3;联氨也有碱性,其碱性弱于氨 (填:强于、弱于);联氨的稳定性弱于氨(填:强于、弱于)
 ,写出戊的电子式
,写出戊的电子式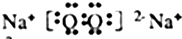 ;
; NaHCO3+NaOH;(用化学反应方程式表示)
NaHCO3+NaOH;(用化学反应方程式表示)