题目内容
10.下列关于“反应先后顺序”的评价中正确的是( )| A. | 向CuSO4溶液中滴加氨水,先生成深蓝色溶液,后生成蓝色沉淀 | |
| B. | 向NH4Fe(SO4)2溶液中滴加少量NaOH溶液,NH4+先发生反应 | |
| C. | 向等浓度的FeCl3和CuCl2混合溶液中加入少量Fe粉,Cu2+先被还原 | |
| D. | 足量锌与浓硫酸反应,先产生二氧化硫,后产生氢气 |
分析 A.向CuSO4溶液中滴加氨水,先生成氢氧化铜沉淀,后沉淀溶解;
B.铁离子先和氢氧根离子反应;
C.铁离子的氧化性大于铜离子;
D.锌和浓硫酸反应生成二氧化硫,和稀硫酸反应生成氢气.
解答 解:A.向CuSO4溶液中滴加氨水,先发生复分解反应生成氢氧化铜沉淀,后氢氧化铜沉淀和一水合氨反应生成铜氨络合物导致沉淀溶解,所以看到的现象是先产生沉淀后沉淀消失,故A错误;
B.铁离子先和氢氧根离子反应生成氢氧化铁沉淀,后铵根离子和氢氧根离子反应生成一水合氨,故B错误;
C.铁离子的氧化性大于铜离子,所以铁离子先参加反应,故C错误;
D.锌和浓硫酸反应生成二氧化硫,和稀硫酸反应生成氢气,随着反应的进行,浓硫酸变为稀硫酸,所以足量的锌和浓硫酸混合有二氧化硫、氢气生成,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,明确离子反应先后顺序是解本题关键,注意A中发生的现象及其原理,注意D中稀硫酸和锌反应,如果将锌换为Cu,就没有氢气产生.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
1.下列说法正确的是( )
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸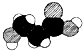 | |
| D. | 化合物 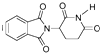 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
18.下列有关化学用语表示正确的是( )
| A. | HClO的结构式:H-Cl-O | |
| B. | NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | 羟基的电子式: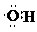 | |
| D. | 异丙醇的结构简式:CH3CH2CH2OH |
15.下列说法正确的是( )
| A. | 电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移 | |
| B. | 含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022 | |
| C. | 28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子 | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
2.反应H2+Cl2=2HCl(△H<0)的机理包含:①Cl2→2Cl(慢)②H2+Cl→HCl+H(快)③Cl2+H→HCl+Cl(快)等.下列说法正确的是( )
| A. | 断开1molH-H键需要的能量小于断开1molCl-Cl键需要的能量 | |
| B. | 反应在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能小于反应②的活化能 | |
| D. | 已知反应②的△H>0,则反应③的△H一定小于0 |
20.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 冶炼铬可采用铝热法 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
 ,G的一种合成路线如下:
,G的一种合成路线如下: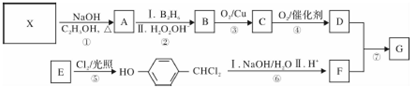
 ;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.请回答下列问题:
;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.请回答下列问题: .
. .
. .
.
 TiO2•XH2O↓+4HCl
TiO2•XH2O↓+4HCl 双氰胺结构简式如图.
双氰胺结构简式如图.