题目内容
2.反应H2+Cl2=2HCl(△H<0)的机理包含:①Cl2→2Cl(慢)②H2+Cl→HCl+H(快)③Cl2+H→HCl+Cl(快)等.下列说法正确的是( )| A. | 断开1molH-H键需要的能量小于断开1molCl-Cl键需要的能量 | |
| B. | 反应在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能小于反应②的活化能 | |
| D. | 已知反应②的△H>0,则反应③的△H一定小于0 |
分析 A.H-H键的键长比Cl-Cl键短,键长越短键能越大;
B.根据盖斯定律可知,化学反应中的能量变化与反应途径无关;
C.活化能越高,反应速率越慢;
D.设反应②H2+Cl→HCl+H (快)③C12+H→HCl+Cl(快)焓变分别为△H2、△H3,然后根据盖斯定律判断.
解答 解:A.H-H键的键长比Cl-Cl键短,键长越短键能越大,则H-H键的键能大于Cl-Cl键,所以断开lmol H-H键需要的能量大于断开1mol Cl-Cl键,故A错误;
B.根据盖斯定律可知,反应H2+C12=2HCl无论在光照条件下还是在加热条件下反应,该反应的△H一定相同,故B错误;
C.活化能越高,反应速率越慢,已知反应①比反应②慢,则反应①的活化能大于②,故C错误;
D.设反应②H2+Cl→HCl+H (快)③C12+H→HCl+Cl(快)焓变分别为△H2、△H3,根据盖斯定律可知:H2+C12=2HCl(△H<0)的△H=△H2+△H3,则△H3=△H-△H2,由于△H<0、△H2>O,则△H3<0,故D正确;
故选D.
点评 本题考查了探究反应机理,题目难度中等,侧重考查化学反应与能量变化的关系,注意明确化学反应实质,能够根据盖斯定律判断反应中焓变大小.

练习册系列答案
相关题目
10.下列关于“反应先后顺序”的评价中正确的是( )
| A. | 向CuSO4溶液中滴加氨水,先生成深蓝色溶液,后生成蓝色沉淀 | |
| B. | 向NH4Fe(SO4)2溶液中滴加少量NaOH溶液,NH4+先发生反应 | |
| C. | 向等浓度的FeCl3和CuCl2混合溶液中加入少量Fe粉,Cu2+先被还原 | |
| D. | 足量锌与浓硫酸反应,先产生二氧化硫,后产生氢气 |
17.A+、B+、C-、D-四种离子两两组成四种可溶性盐,其中AC和BD的盐溶液的pH=7,BC盐溶液pH>7,则下列说法正确的是( )
| A. | AD盐溶液pH>7 | B. | .酸的电离程度一定是HD<HC | ||
| C. | .碱的电离程度一定是AOH>BOH | D. | .在AC盐溶液中c(A+)+c(AOH)=c(C-)+c(HC) |
7.下列有关化学的基本概念、规律和原理正确的是( )
| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 不同元素的原子构成的分子中只含极性共价键 | |
| C. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
14.下列实验操作和现象与结论对应关系正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测量等浓度的Na2CO3与C6H5ONa溶液的pH | Na2CO3溶液的pH大于C6H5ONa的pH | H2CO3的酸性大于C6H5OH |
| B | 将SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| C | 取少量的变质FeCl2晶体于试管中,逐滴加入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | FeCl2未完全变质 |
| D | 向苯酚的苯溶液中加入足量NaOH溶液,振荡静置 | 分层 | 上层为苯,下层为NaOH与苯酚钠的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
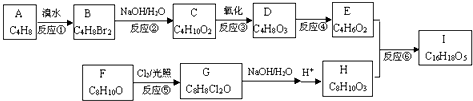
 .
. .
.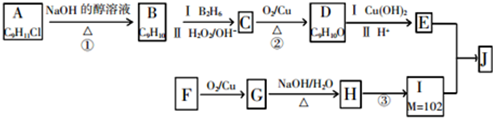
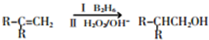
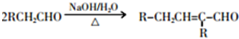
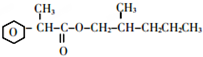 .
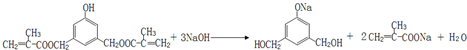
.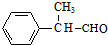 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$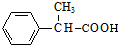 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.
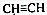 和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.
和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.