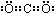题目内容
20.下列对一些实验事实和理论解释正确的是( )| 选项 | 实验事实 | 理论解释 |
| A | Na与水反应失去1个电子,Mg与水反应失去2个电子 | Na的金属性比Mg强 |
| B | 氢溴酸的酸性强于盐酸的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.金属性与失电子能力有关;
B.氢化物的稳定性越强,非金属性越强;
C.离子化合物在熔融状态下能电离出离子;
D.沸点高低与分子间作用力有关.
解答 解:A.金属性与失电子能力有关,越易失电子,金属性越强,与失电子数多少无关,故A错误;
B.氢化物的稳定性越强,非金属性越强,不能根据氢化物酸性判断非金属性,故B错误;
C.离子化合物在熔融状态下能电离出离子,K3C60在熔融状态下能够导电,说明K3C60在熔融状态下电离出离子属于离子化合物,故C正确;
D.沸点高低与分子间作用力有关,HF的沸点高于HCl,说明HF中分子间作用力大于HCl,不能根据沸点高低判断非金属性,故D错误.
故选C.
点评 本题考查了非金属性和金属性强弱的判断,题目难度不大,注意把握非金属性和金属性强弱的判断角度.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
10.已知元素的电负性、电离能和原子半径等内容一样,也是元素的一种基本性质,
(1)下面给出14种元素的电负性:
试结合元素周期律知识完成下列问题:
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化,同主族元素从上至下,电负性逐渐同主族元素从上至下电负性减小.
②预测元素电负性的大小关系:Br>I,
电负性最小的元素在周期表中的位置是第6周期ⅠA族 (放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是共价键.
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:
①通过上述信息和表中的数据分析为什么锂原子失去核外第2个电子时所需的能量要远远大于失去第1个电子所需的能量Li原子失去1个电子后形成稳定结构,此时再失去1个电子很困难.
②表中X Y为第3周期元素,则X为Na,Y为Al.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是Ar.(均填元素符号)
(1)下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化,同主族元素从上至下,电负性逐渐同主族元素从上至下电负性减小.
②预测元素电负性的大小关系:Br>I,
电负性最小的元素在周期表中的位置是第6周期ⅠA族 (放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是共价键.
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:
| 锂 | X | Y | |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | 9550 | 11600 |
②表中X Y为第3周期元素,则X为Na,Y为Al.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是Ar.(均填元素符号)
11.用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.下列化学用语正确的是( )
| A. | 三氟化氮的电子式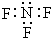 | B. | 水合氢离子电子式: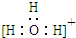 | ||
| C. | 氟离子的结构示意图: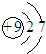 | D. | 中子数为18的硫原子${\;}_{16}^{34}$S |
5.在下列各说法中,正确的是( )
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0表示放热,△H<0表示吸热 | |
| C. | 0.5mol H2SO4与0.5molBa(OH)2反应生成1mol水时放出的热叫做中和热 | |
| D. | 1molH2与0.5molO2燃烧放出的热就是H2的燃烧热 |
12.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH═CH3COO-+H+,要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大,可以采取的措施有( )
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水.
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水.
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
10.下列关于同主族元素的说法错误的是( )
| A. | 同主族元素随原子序数递增,元素原子的得电子能力逐渐增强 | |
| B. | 同主族元素随原子序数递增,单质氧化能力逐渐增强 | |
| C. | 同主族元素原子最外层电子数都相同 | |
| D. | 同主族元素的原子半径,随原子序数增大而逐渐增大 |
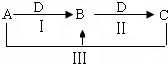 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).