题目内容
12.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH═CH3COO-+H+,要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大,可以采取的措施有( )①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水.
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
分析 要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大,应是平衡向电离的方向移动,结合影响平衡移动的因素解答该题.
解答 解:①加入烧碱溶液,反应生成CH3COO-,c(H+)减小,促进CH3COOH的电离,则比值减小,故错误;
②弱电解质的电离为吸热过程,加热促进电离,则比值增大,故正确;
③加少量冰醋酸,醋酸浓度增大,弱电解质的浓度越大,电离程度越小,则比值减小,故错误;
④加水,溶液体积增大,导致氢离子、醋酸浓度都减小,但是电离平衡:CH3COOH?CH3COO-+H+正向移动,氢离子浓度减的少,醋酸浓度减的大,所以比值增大,故正确.
故选B.
点评 本题考查弱电解质的电离,侧重于考查学生的分析能力和化学基本概念的理解和应用能力,为高考常见题型,难度中等,注意把握影响弱电解质的电离的影响因素.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列对一些实验事实和理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | Na与水反应失去1个电子,Mg与水反应失去2个电子 | Na的金属性比Mg强 |
| B | 氢溴酸的酸性强于盐酸的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
4.关于化学键的下列叙述中,正确的是( )
| A. | 离子化合物一定含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中肯定不含离子键 |
1.下列物质中含有共价键的离子化合物是( )
| A. | NaNO3 | B. | MgCl2 | C. | SiO2 | D. | C2H4 |
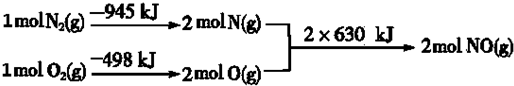
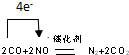 .
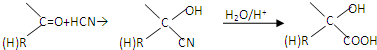
.
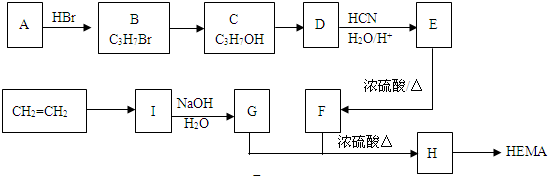
 .
. .
.