题目内容
10.已知元素的电负性、电离能和原子半径等内容一样,也是元素的一种基本性质,(1)下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化,同主族元素从上至下,电负性逐渐同主族元素从上至下电负性减小.
②预测元素电负性的大小关系:Br>I,
电负性最小的元素在周期表中的位置是第6周期ⅠA族 (放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是共价键.
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:
| 锂 | X | Y | |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | 9550 | 11600 |
②表中X Y为第3周期元素,则X为Na,Y为Al.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是Ar.(均填元素符号)
分析 (1)①从同周期元素自左到右排列,然后结合数据分析;
②同主族自上而下,电负性逐渐减小;
③根据溴元素和铝元素的电负性差值判断;
(2)①锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,锂离子处于稳定结构;
②由表中数据可知,X的第二电离能剧增,故X表现+1价,处于第ⅠA族,且第一电离能比Li的小,说明比锂的金属性强,应为上述元素中的Na元素;由表中数据可知,Y的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素,应为上述元素中的Al,处于零族元素已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多.
解答 解:(1)①由表中数据可知,第二周期元素从Li~F,随着原子序数的递增,元素的电负性逐渐增大,第三周期元素从Na~S,随着原子序数的递增,元素的电负性也逐渐增大,并呈周期性变化,周主族元素从上至下电负性减小;
故答案为:在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化;同主族元素从上至下电负性减小;
②同主族自上而下,电负性逐渐减小,因此电负性Br>I,电负性最小的元素在周期表中的位置处于左下角的金属性强的元素,应是第6周期ⅠA族,
故答案为:>;第6周期ⅠA族;
③AlBr3中,Al元素的电负性为1.61,Br元素的电负性小于3.16,则二者差值小于1.7,AlBr3中化学键类型为共价键,故答案为:共价键;
(2)①锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,锂离子处于稳定结构,根据题给信息可知,要使锂离子再失去电子便会形成不稳定结构,因此锂原子失去第二个电子时所需能量远大于失去第一个电子所需的能量,
故答案为:Li原子失去1个电子后形成稳定结构,此时再失去1个电子很困难;
②由表中数据可知,X的第二电离能剧增,故X表现+1价,处于第ⅠA族,且第一电离能比Li的小,说明比锂的金属性强,应为上述元素中的Na元素;由表中数据可知,Y的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素,应为上述元素中的Al,处于零族元素已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多Ar,故答案为:Na;Al;Ar.
点评 本题考查了电负性的含义和应用,难度不大,一般情况下电负性的变化规律与元素非金属性的变化规律一致.

| A. | 钡 | B. | 铁 | C. | 钙 | D. | 碘 |
| A. | 12 g14C中含有的中子数是8NA | |
| B. | 28g氮气含有的原子数是2NA | |
| C. | 1mol铁与足量稀硝酸完全反应,失去的电子数3NA | |
| D. | 标准状况下,4.48 L NO和2.24 L O2混合气体中含分子总数为0.3NA |
| A. | V1:V2≥11:1 | B. | V1:V2≥9:1 | C. | V1:V2≤11:1 | D. | V1:V2≤1:9 |
| 选项 | 实验事实 | 理论解释 |
| A | Na与水反应失去1个电子,Mg与水反应失去2个电子 | Na的金属性比Mg强 |
| B | 氢溴酸的酸性强于盐酸的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
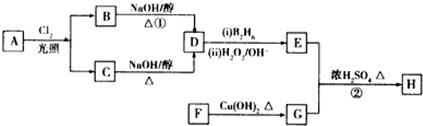
 .
. .
.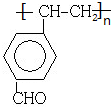 .
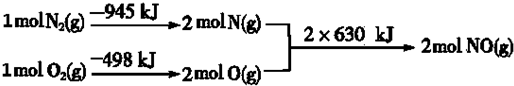
.
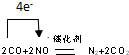 .
.