题目内容
5.在下列各说法中,正确的是( )| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0表示放热,△H<0表示吸热 | |
| C. | 0.5mol H2SO4与0.5molBa(OH)2反应生成1mol水时放出的热叫做中和热 | |
| D. | 1molH2与0.5molO2燃烧放出的热就是H2的燃烧热 |
分析 A、热化学方程式中的化学计量既表示物质的量也可以表示个数;
B、焓变△H>0表示吸热反应,△H<0,表示放热反应;
C、中和热的本质是在稀溶液中,1mol氢离子与1mol氢氧根反应,生成1mol水放出的热量;
D、在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.
解答 解:A、热化学方程式中的化学计量既表示物质的量也可以表示个数,所以可以是分数,故A正确;
B、焓变△H>0表示吸热反应,△H<0,表示放热反应,故B错误;
C、生成水的物质的量虽然是1mol,且有钡离子与硫酸根反应生成硫酸钡沉淀,也有热量放出,故C错误;
D、应在25℃,101 kPa,且生成的水应为液态才是燃烧热,故D错误.
故选:A.
点评 注意中和热必须是酸和碱的稀溶液,1mol氢离子与1mol氢氧根反应,生成1mol水,因为浓酸溶液和浓碱溶液在相互稀释时会放热;
燃烧热注意定义要点:①规定在101 kPa压强,常温25度下测出热量,因为压强和温度不定,反应热数值不相同.
②规定可燃物物质的量为1 mol.
③规定可燃物完全燃烧生成稳定化合物所放出的热量为标准

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
15.室温下,pH=13的碱溶液V1mL与pH=2的硫酸溶液V2mL混合,得混合液pH=11,则V1:V2为( )
| A. | V1:V2≥11:1 | B. | V1:V2≥9:1 | C. | V1:V2≤11:1 | D. | V1:V2≤1:9 |
16.将11.2g铁粉加入250mL 2mol/L氯化铁溶液中充分反应后,结果是( )
| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,溶液变红色 | |
| C. | Fe2+和Fe3+物质的量之比为5:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |
13.A气体的水溶液呈酸性,若将A通入酸性的KMnO4溶液中,则紫红色褪色;若将A通入Br2水中,则Br2褪色并出现浑浊,则A气体是( )
| A. | Cl2 | B. | SO2 | C. | H2S | D. | CO2 |
20.下列对一些实验事实和理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | Na与水反应失去1个电子,Mg与水反应失去2个电子 | Na的金属性比Mg强 |
| B | 氢溴酸的酸性强于盐酸的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
14.下列叙述中,正确的是( )
| A. | 两种原子,如果核外电子排布相同,则一定属于同种元素 | |
| B. | 两种微粒,若质量数不同,则其化学性质一定不同 | |
| C. | 两种微粒,若质量数相同,则其化学性质一定相同 | |
| D. | 微粒的核外电子数相同,则一定属于同种元素 |
 .
. .
.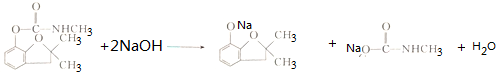 .
. 的两步化学方程式
的两步化学方程式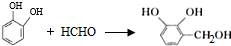 、
、 .
.