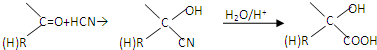
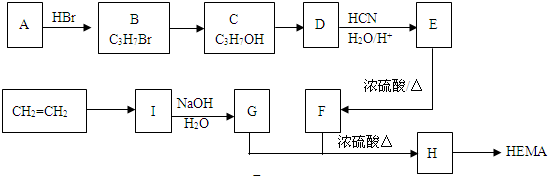
题目内容
11.用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 根据烷基式量为43的确定烷基,再判断可能的烷基异构情况,利用等效H判断甲苯苯环上的H原子种类有3种,据此判断.
解答 解:烷基组成通式为CnH2n+1,烷基式量为43,所以14n+1=43,解得n=3,所以烷基为-C3H7.
当为正丙基,甲苯苯环上的H原子种类有3种,所以有3种同分异构体.
当为异丙基,甲苯苯环上的H原子种类有3种,所以有3种同分异构体.故该芳香烃产物的种类数为6种.
故选D.
点评 本题主要考查同分异构体的书写,难度中等,关键根据烷基式量为43的确定烷基,判断可能的烷基异构情况.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列元素中,不属于主族元素的是( )
| A. | 钡 | B. | 铁 | C. | 钙 | D. | 碘 |
16.将11.2g铁粉加入250mL 2mol/L氯化铁溶液中充分反应后,结果是( )
| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,溶液变红色 | |
| C. | Fe2+和Fe3+物质的量之比为5:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |
20.下列对一些实验事实和理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | Na与水反应失去1个电子,Mg与水反应失去2个电子 | Na的金属性比Mg强 |
| B | 氢溴酸的酸性强于盐酸的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
1.下列物质中含有共价键的离子化合物是( )
| A. | NaNO3 | B. | MgCl2 | C. | SiO2 | D. | C2H4 |
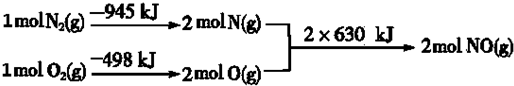
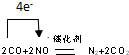 .
.
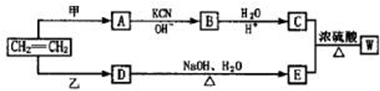
 ,若W为一高分子化合物,其结构简式为
,若W为一高分子化合物,其结构简式为 .
.