题目内容
15.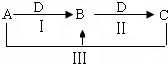 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).(1)若A为氯碱工业的产品,C为厨房中的用品.
①氯碱工业制备A的化学方程式是2NaCl+2H2$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
②D的电子式是
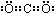
③反应Ⅲ的离子方程式是HCO3-+OH-=H2O+CO32-
(2)若A、D均为单质,且A为气体,D元素的常见价态为+2,+3,一种氧化物为红棕色.
①反应Ⅲ的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+
②B可作净水剂,其原理是Fe3++3H2O=Fe(OH)3+3H+(用离子方程式表示).
分析 (1)氯碱工业的产品为氢氧化钠、氢气和氯气,且A可生成C,C为厨房中用品,A和C反应生成B,A、B、C含有同一种元素,所以A为氢氧化钠,C为碳酸氢钠,B为碳酸钠,D为二氧化碳;根据推断写出D的电子式,反应Ⅲ的离子方程式、制备A的化学方程式,根据转移的电子数判断碘化钾转化为碘酸钾,写出离子方程式;
(2)D为单质且D元素的一种红棕色氧化物常用作颜料,所以D为铁;A为气体单质,与铁反应生成B,B和铁反应生成C,A和铁反应生成B,所以A为氯气,B为氯化铁,C为氯化亚铁,带入验证符合题意;根据推断写出反应Ⅲ的离子方程式并分析B是铁盐水解生成氢氧化铁胶体具有吸附悬浮杂质的作用.
解答 解:(1)氯碱工业的产品为氢氧化钠、氢气和氯气,且A可生成C,C为厨房中用品,A和C反应生成B,A、B、C含有同一种元素,所以A为氢氧化钠,C为碳酸氢钠,B为碳酸钠,D为二氧化碳;
①氯碱工业中制备A的化学方程式为:2NaCl+2H2$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
故答案为:2NaCl+2H2$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
②二氧化碳中碳的最外层只有四个电子,与氧形成四对共用电子对,达到稳定结构,电子式为: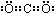 ;
;
故答案为: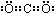 ;
;
③反应Ⅲ为氢氧化钠和碳酸氢钠反应生成碳酸钠和水,根据离子方程式的书写方法可知该反应的离子方程式为:HCO3-+OH-=H2O+CO32-;
故答案为:HCO3-+OH-=H2O+CO32-;
(2)D为单质且D元素的一种红棕色氧化物常用作颜料,所以D为铁;A为气体单质,与铁反应生成B,B和铁反应生成C,A和铁反应生成B,所以A为氯气,B为氯化铁,C为氯化亚铁;
①反应Ⅲ为氯气和氯化亚铁反应生成氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;
②氯化铁为强酸弱碱盐,在水中发生水解Fe3++3H2O?Fe(OH)3+3H+,生成氢氧化铁胶体,可起到净水作用;
故答案为:Fe3++3H2O=Fe(OH)3+3H+.
点评 本题为无机推断题,考查了氯碱工业;氢氧化钠、碳酸钠和碳酸氢钠的转化,铁及其化合物的性质,题目难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | 12 g14C中含有的中子数是8NA | |
| B. | 28g氮气含有的原子数是2NA | |
| C. | 1mol铁与足量稀硝酸完全反应,失去的电子数3NA | |
| D. | 标准状况下,4.48 L NO和2.24 L O2混合气体中含分子总数为0.3NA |
| A. | NaOH | B. | 浓H2SO4 | C. | Na2O2 | D. | 浓盐酸 |
| 选项 | 实验事实 | 理论解释 |
| A | Na与水反应失去1个电子,Mg与水反应失去2个电子 | Na的金属性比Mg强 |
| B | 氢溴酸的酸性强于盐酸的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 离子化合物一定含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中肯定不含离子键 |
| A. | 氯化氢的电子式: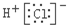 | B. | N2的结构式:N≡N | ||
| C. | 硫离子结构示意图: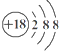 | D. | 四氯化碳的电子式: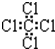 |

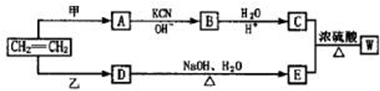
 ,若W为一高分子化合物,其结构简式为
,若W为一高分子化合物,其结构简式为 .
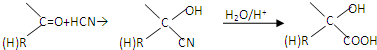
.
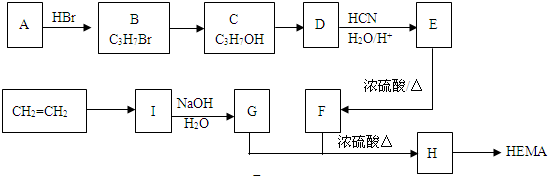
 .
.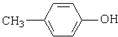 .
.