题目内容
12.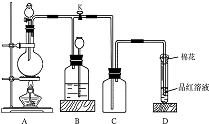 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:Ⅰ.(1)盛放药品前,检验此装置的气密性的操作方法和现象是:将D装置中导管口浸没在水面下,关闭分液漏斗活塞,打开K,微热A装置,D的导管口有气泡冒出;关闭K,长颈漏斗中液面上升(B瓶中液面下降),说明装置不漏气
(2)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(3)装置D中试管口放置的棉花中应浸有一种液体,这种液体是碱液其作用是:吸收多余的二氧化硫
(4)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)d
a.水 b.浓溴水; c.KMnO4酸性溶液 d.NaHSO3饱和溶液
Ⅱ.两位同学设计了下述两个方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证无色混合气体中含有CO2和SO2.
方案甲:无色气体→酸性KMnO4(褪色)→澄清石灰水(浑浊)
方案乙:无色气体→足量品红溶液(颜色变浅)→澄清石灰水(浑浊)
试评价上述各方案是否严密,并说明理由:甲不严密;高锰酸钾是一种强氧化剂,它可以氧化二氧化硫、硫化氢等具有还原性的气体,因此使高锰酸钾褪色的气体,不一定只是二氧化硫;
乙严密;能使过量的品红溶液变浅的无色气体只有二氧化硫,余下的气体能使澄清的石灰水变浑浊,只能是二氧化碳气体.
分析 Ⅰ.(1)通过微热A装置,根据D导管中是否产生气泡及关闭K时长颈漏斗中液面是否变化检验装置气密性;
(2)加热条件下,Cu和浓硫酸发生氧化还原反应生成二氧化硫、硫酸铜和水;
(3)二氧化硫属于酸性氧化物,且有毒,不能排入空气中,应该用碱液吸收;
(4)B中盛放的液体不能和二氧化硫反应;
Ⅱ.酸性高锰酸钾溶液能氧化二氧化硫、硫化氢等具有还原性的气体,且高锰酸钾溶液的量是否过量未知;
能使过量的品红溶液变浅的无色气体只有二氧化硫,从而除去二氧化硫,二氧化碳能使澄清石灰水变浑浊.
解答 解:Ⅰ.(1)气密性检验操作方法及现象为将D装置中导管口浸没在水面下,关闭分液漏斗活塞,打开K,微热A装置,D的导管口有气泡冒出;关闭K,长颈漏斗中液面上升(B瓶中液面下降),说明装置不漏气,
故答案为:将D装置中导管口浸没在水面下,关闭分液漏斗活塞,打开K,微热A装置,D的导管口有气泡冒出;关闭K,长颈漏斗中液面上升(B瓶中液面下降),说明装置不漏气;
(2)加热条件下,Cu和浓硫酸发生氧化还原反应生成二氧化硫、硫酸铜和水,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)二氧化硫属于酸性氧化物,且有毒,不能排入空气中,否则会污染大气,应该用碱液吸收,所以D中液体是碱液,目的是吸收多余的二氧化硫,
故答案为:碱液;吸收多余的SO2;
(4)B装置的作用是贮存多余的二氧化硫和防止其污染环境,则二氧化硫和该物质不能反应,二氧化硫具有还原性,能溶于水生成亚硫酸,能被强氧化剂溴、酸性高锰酸钾溶液氧化,和亚硫酸氢钠不反应,故选d;
Ⅱ.酸性高锰酸钾溶液能氧化二氧化硫、硫化氢等具有还原性的气体,且高锰酸钾溶液的量是否过量未知,所以甲不严密;
能使过量的品红溶液变浅的无色气体只有二氧化硫,从而除去二氧化硫,二氧化碳能使澄清石灰水变浑浊,所以通入品红溶液后剩余气体是二氧化碳,所以乙严密,
故答案为:甲不严密;高锰酸钾是一种强氧化剂,它可以氧化二氧化硫、硫化氢等具有还原性的气体,因此使高锰酸钾褪色的气体,不一定只是二氧化硫;
乙严密;能使过量的品红溶液变浅的无色气体只有二氧化硫,余下的气体能使澄清的石灰水变浑浊,只能是二氧化碳气体.
点评 本题以Cu和浓硫酸反应为载体考查性质实验方案设计及实验方案评价,侧重考查实验基本操作、物质的性质等知识点,明确实验原理及物质的性质是解本题关键,知道装置中各个装置的作用及可能发生的反应,难点是II的分析解答,题目难度中等.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | 不用其它试剂便无法区别NaCl、Na2CO3、NaHSO4、AlCl3四种溶液 | |
| B. | 实验室常用带玻璃塞的试剂瓶保存NaOH溶液 | |
| C. | 用导线将电解池和电池连接,电子从电池的负极流向电解池的阳极 | |
| D. | 用以下反应制取硫酸铜:2Cu+O2═2CuO、CuO+H2SO4=CuSO4+H2O符合绿色化学的理念 |
| A. | 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| B. | 除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤 | |
| C. | 除去FeC13 酸性溶液中少量的FeC12:加入稍过量双氧水后放置 | |
| D. | 除去蛋白质溶液中混入的少量氯化钠:加AgNO3溶液后过滤 |
| A. | X=Y+0.01 | B. | X=2Y | C. | Y=2X | D. | X=Y+0.02 |
| A. | 8倍 | B. | 10倍 | C. | 12倍 | D. | 14倍 |
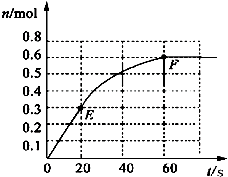 373K时,某1L密闭容器中加入1mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
373K时,某1L密闭容器中加入1mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.