题目内容
1.150℃时,碳酸铵完全分解为气态混合物,其密度为相同条件下氢气的( )| A. | 8倍 | B. | 10倍 | C. | 12倍 | D. | 14倍 |
分析 由方程式可知,生成的混合气体中氨气、水蒸气、二氧化碳的摩尔分数分别为0.5、0.25、0.25,先根据¯M¯¯¯¯¯¯M=Mr1×x1+Mr2×x2+…+Mri×xi计算混合气体平均相对分子质量(其中Mri代表各组分相对分子质量、xi代表各组分摩尔分数),再利用密度之比等于相对分子质量之比计算.
解答 解:由(NH4)2CO3加热_2NH3↑+H2O↑+CO2↑可知,1mol(NH4)2CO3分解生成的混合气体中氨气、水蒸气、二氧化碳的摩尔分数分别为0.5、0.25、0.25,则混合气体¯M=17×0.5+18×0.25+44×0.25=24,因气体密度之比等于相对分子质量之比,所以混合气的密度是相同条件下的氢气密度的242=12倍,
故选C.
点评 本题结合铵盐的化学性质考查了阿伏伽德罗定律推论应用等,题目难度不大,注意对基础知识的理解掌握,侧重分析能力及计算能力的考查.

练习册系列答案
相关题目
6.下列有机物的命名正确的是( )
| A. | 1-甲基戊烷 | B. | 2,3-二甲基戊烷 | C. | 3-戊烯 | D. | 3,4-二甲基戊烷 |
13.对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法.下列有关说法中正确的是( )
| A. | 目前工业上常用电解熔融氯化钠法制钠,电解时可用铁作阳极 | |
| B. | 电解熔融CaCl2时,金属钙在阳极生成 | |
| C. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| D. | 电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解 |
10.属于氧化还原反应的离子方程式的是( )
| A. | CaCO3+2H+=Ca2++CO2↑+H2O | B. | 2Fe2++Cl2=2Fe3++2Cl- | ||
| C. | HCO3-+H+=CO2↑+H2O | D. | Na2O+H2O=2Na++2OH- |

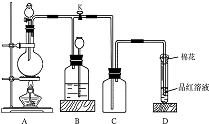 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:

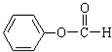

 (1)已知热化学方程式如下:N2(g)+3H2O(1)═2NH3(g)+
(1)已知热化学方程式如下:N2(g)+3H2O(1)═2NH3(g)+