题目内容
7.将物质的量浓度为Xmol/L的稀盐酸与物质的量浓度为Xmol/L的稀NaOH溶液等体积混合,所得溶液的pH=2(混合后体积不变),则X和Y的关系是( )| A. | X=Y+0.01 | B. | X=2Y | C. | Y=2X | D. | X=Y+0.02 |
分析 盐酸和氢氧化钠都为强电解质,根据酸碱混合后溶液呈酸性,故H+过量,根据C(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{酸}+{V}_{碱}}$来计算.
解答 解:盐酸和氢氧化钠都为强电解质,酸碱混合后发生反应H++OH-=H2O,溶液呈酸性,故H+过量,设酸和碱的体积均为VL,混合后溶液中:C(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{酸}+{V}_{碱}}$=$\frac{XV-YV}{2V}$=10-2mol/L,
解得:X=Y+0.02,
故选D.
点评 本题考查了酸碱混合后的pH的有关计算,明确混合后溶液显酸性、掌握公式的使用是关键,题目难度不大.

练习册系列答案
相关题目
8.在容积不变的密闭容器中,在一定条件下发生反应:2A?B(g)+C(g),且达到平衡.当升高温度时气体的密度增大,则( )
| A. | 若正反应是吸热反应,则A为非气态 | B. | 若正反应是吸热反应,则A为气态 | ||
| C. | 若正反应是放热反应,则A为气态 | D. | 若正反应是放热反应,则A为非气态 |
18.下列说法正确的是( )
| A. | 凡金属元素与非金属元素之间都形成离子键 | |
| B. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| C. | 含有离子键的化合物中,也可能还含有共价键 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |
15.常温下,下列各组离子一定能大量共存的是( )
| A. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | [H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | [OH-]/[H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、[Al(OH)4]-、HCO3- |
2.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述正确的是( )
| A. | NH4H是共价化合物 | B. | NH4H溶于水,所形成的溶液显碱性 | ||
| C. | NH4H与水反应时,水作还原剂 | D. | NH4H中的H元素只有一种化合价 |
17.下列有关金属的工业制法中,正确的是( )
| A. | 制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛 | |
| B. | 炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中的铁 | |
| C. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| D. | 炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
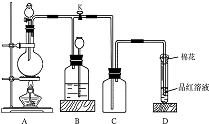 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题: