��Ŀ����
2�����н�������A��B��C��I������ס��ҡ���������D��E��F��G��H������B�ǵؿ��к������Ľ���������֮���ܷ������·�Ӧ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������
�����������Ϣ�ش��������⣺
��1��д���������ʵĻ�ѧʽ��CFe��HFe��OH��3
��2��д����Ӧ�۵����ӷ���ʽ��2Al+2H2O+2OH-=2AlO2-+3H2��
д����Ӧ�ߵ����ӷ���ʽ��2Fe3++Cu=2Fe2++Cu2+
��3��ʵ���Ҽ�������G�������ӵij����Լ��ǣ�KSCN
ʵ���Ҽ�������D�������ӵķ�������ɫ��Ӧ
��4��������Ӧ��3H2O2+2H2CrO4=2Cr��OH��3+3O2+2H2O�÷�Ӧ�еĻ�ԭ����H2O2����ԭ������Cr��OH��3�����÷�Ӧת����0.3mol���ӣ�������������ڱ�״̬�����ԼΪ3.36L��
���� ����A����ɫ��ӦΪ��ɫ��ӦΪNa�����ΪH2��DΪNaOH��BӦΪAl������ɫ������ΪCl2����ΪHCl��EΪ���ᣬ���ɫ����HΪFe��OH��3��GΪFeCl3��FΪFeCl2��CΪFe���Ϻ�ɫ����IΪCu����϶�Ӧ���ʵ������Լ���ĿҪ������⣮
��� �⣺����A����ɫ��ӦΪ��ɫ��ӦΪNa�����ΪH2��DΪNaOH��BӦΪAl������ɫ������ΪCl2����ΪHCl��EΪ���ᣬ���ɫ����HΪFe��OH��3��GΪFeCl3��FΪFeCl2��CΪFe���Ϻ�ɫ����IΪCu��
��1��������������֪��CΪFe��HΪFe��OH��3���ʴ�Ϊ��Fe��Fe��OH��3��
��2����Ӧ�۵����ӷ���ʽΪ��2Al+2H2O+2OH-=2AlO2-+3H2������Ӧ�ߵ����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+��
�ʴ�Ϊ��2Al+2H2O+2OH-=2AlO2-+3H2����2Fe3++Cu=2Fe2++Cu2+��
��3��G��������ΪFe3+��ʵ���Ҽ�������G�������ӵij����Լ���KSCN��Һ���������������������Һ���ɫ��DΪNaOH��������ɫ��Ӧ���������ӣ�
�ʴ�Ϊ��KSCN����ɫ��Ӧ��
��4���÷�Ӧ��ʧ���ӻ��ϼ����ߵķ�Ӧ����H2O2���õ��ӻ��ϼ۽��͵�Ԫ����H2CrO4�е�Cr��+6�۵�Cr�����Ա���ԭ��Ԫ����Cr6+����H2CrO4��������������ԭ��Ӧ����ԭ������Cr��OH��3�����ݵ�ʧ�����غ���������������ʵ���Ϊ$\frac{0.3mol}{2}$�T0.15mol����������������Ϊ��0.15mol��22.4L/mol=3.36L���ʲ������������Ϊ3.36L��
�ʴ�Ϊ��H2O2��Cr��OH��3��3.36L��
���� ������Ԫ�ػ�������ƶ�Ϊ���忼����Ԫ�ػ���������ʣ�Ϊ�߿��������ͣ�������ѧ���ķ��������Ŀ��飬��ȷ�ƶ����ʵ������ǽⱾ��Ĺؼ������Ԫ�ػ������������������ɣ���Ŀ�ѶȲ���

| A�� | Ŀǰ��ҵ�ϳ��õ�������Ȼ��Ʒ����ƣ����ʱ������������ | |
| B�� | �������CaCl2ʱ������������������ | |
| C�� | ���õ�ⱥ��MgCl2��Һ�ķ�����ý���þ | |
| D�� | �������Al2O3�Ʊ�������ʱ��Ҫ�������ʯ��ʹAl2O3�ڽϵ��¶����۽� |
| A�� | CaCO3+2H+=Ca2++CO2��+H2O | B�� | 2Fe2++Cl2=2Fe3++2Cl- | ||
| C�� | HCO3-+H+=CO2��+H2O | D�� | Na2O+H2O=2Na++2OH- |
| A�� | ���ѣ��ý������û��Ȼ��ѣ�TiCl4����Һ�е��� | |
| B�� | �������ý�̿�Ϳ�����Ӧ������CO�ڸ����»�ԭ����ʯ�е��� | |
| C�� | ���ƣ��ú�ˮΪԭ���Ƶþ��Σ��ٵ�ⴿ����NaCl��Һ | |
| D�� | ��ͭ���û�ͭ����Ҫ�ɷ�ΪCuFeS2��ֱ�ӵ�⾫���õ�����Ϊ99.9%��ͭ |
 ���и��������У�������ͼ����һ��ת����ϵ��ѡ���ǣ�������
���и��������У�������ͼ����һ��ת����ϵ��ѡ���ǣ�������| X | Y | Z | |
| A | Na | NaOH | NaHCO3 |
| B | S | SO3 | SO2 |
| C | Cu | CuO | CuSO4 |
| D | Si | SiO2 | H2SiO3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | AgNO3��Na2CO3��HNO3 | B�� | Na2CO3��AgNO3��HNO3 | ||
| C�� | AgNO3��K2CO3��HNO3 | D�� | AgNO3��Na2CO3��HCl |
| A�� | ����ʳ��ˮ | B�� | ��������ͭ��Һ | C�� | ��� | D�� | ����Ũ���� |
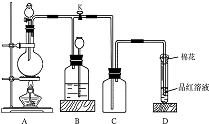 ��ͼ��ʾװ��Ϊͭ��Ũ���ᷴӦ��ȡ���������ʵ��װ�ã���ش��������⣺
��ͼ��ʾװ��Ϊͭ��Ũ���ᷴӦ��ȡ���������ʵ��װ�ã���ش��������⣺ ��1����֪�Ȼ�ѧ����ʽ���£�N2��g��+3H2O��1���T2NH3��g��+$\frac{3}{2}$O2��g������H=+765.2kJ•mol-1����������ͼ�У�����������Ӧ��������ϵ�����仯ʾ��ͼ�������б�Ҫ��ע��
��1����֪�Ȼ�ѧ����ʽ���£�N2��g��+3H2O��1���T2NH3��g��+$\frac{3}{2}$O2��g������H=+765.2kJ•mol-1����������ͼ�У�����������Ӧ��������ϵ�����仯ʾ��ͼ�������б�Ҫ��ע��