��Ŀ����
4��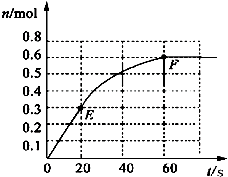 373Kʱ��ij1L�ܱ������м���1mol NH3�������¿��淴Ӧ��2NH3��g��?N2��g��+3H2��g������������H2�����ʵ����仯��ͼ��ʾ��
373Kʱ��ij1L�ܱ������м���1mol NH3�������¿��淴Ӧ��2NH3��g��?N2��g��+3H2��g������������H2�����ʵ����仯��ͼ��ʾ����1��ǰ20s��NH3��g����ƽ����Ӧ����Ϊ0.01mol/L•s��
��2��373Kʱ�÷�Ӧ��ƽ�ⳣ����ֵΪ0.12��
��3�����ڴ�ƽ����ϵ���ټ���1mol��NH3����ԭƽ��Ƚϣ���ƽ��ʱNH3��ת���ʼ�С�������С������ͬ����NH3��ƽ��Ũ������
��4����ԭƽ��������473K�����´�ƽ��ʱ�������������䣩��H2��ƽ��Ũ��ΪNH3��2�����÷�Ӧ������ӦΪ���ȣ�����ȷ�Ӧ�������ȷ�Ӧ������Ϊ����ƽ����ϵ��H2�����ʵ��������д�ʩ��ȷ����ab������������ͬ��
a�������¶� b��������������� c��������ʵĴ��� d���ٳ���N2��
���� ��1������ͼ�����60s�ﵽƽ�⣬B�����ʵ����仯Ϊ0.6mol������õ�B�ķ�Ӧ���ʣ����ʵ������֮�ȵ��ڻ�ѧ����ʽ������֮�ȼ���õ�A�ķ�Ӧ���ʣ�
��2������ƽ�ⳣ���ĸ�������������ƽ��Ũ�ȵ��ݴη��˻����Է�Ӧ��ƽ��Ũ�ȵ��ݴη��˻��õ���
��3����������Ũ�ȣ���Ӧ����������A�൱��������ϵѹǿ������ѹǿ��ƽ��������У�����ת���ʼ�С������ƽ��Ũ������
��4���¶����ߣ�B��Ũ������Ӧ������У���Ӧ�����ȷ�Ӧ��ƽ�ⳣ�����¶ȱ仯��
��� �⣺��1��ǰ 20 s���������ʵ����仯��Ϊ0.3mol�������ı仯��Ϊ��0.2mol��20 s��NH3��g����ƽ����Ӧ����Ϊv=$\frac{\frac{0.2mol}{1L}}{20s}$=0.01mol/��L•s�����ʴ�Ϊ��0.01mol/��L•s����
��2��2NH3��g��?N2��g��+3H2��g��
����1mol 0 0
�仯��0.4mol 0.2mol 0.6mol
ƽ�⣺0.6mol 0.2mol 0.6mol
����ƽ�ⳣ��K=$\frac{\frac{0.2}{1}����\frac{0.6}{1}��^{3}}{��\frac{0.6}{1}��^{2}}$=0.12���ʴ�Ϊ��0.12��
��3����������Ũ�ȣ���Ӧ���������백���൱��������ϵѹǿ������ѹǿ��ƽ��������У�����ת���ʼ�С������ƽ��Ũ�����ʴ�Ϊ����С������
��4����ԭƽ�������� 473K�����´�ƽ��ʱ�������������䣩��H2��ƽ��Ũ��ΪNH3��2����˵��ƽ��������Ӧ�����ƶ�������Ӧ�����ȷ�Ӧ��Ϊ����ƽ����ϵ��H2�����ʵ�������ʹƽ�������ƶ���a�������¶� b������������������Դﵽ���ʴ�Ϊ�����ȷ�Ӧ��ab��
���� ���⿼���˻�ѧƽ����ƶ�ԭ��Ӧ�ã���Ӧ���ʵ�Ӱ�����ط�����ƽ�ⳣ���ļ����Ӱ�����أ�ע��ƽ�ⳣ�����¶ȱ仯����Ŀ�Ѷ��еȣ�

| A�� | NH4HCO3���ڹ�����NaOH��Һ�У�HCO3-+OH-�TCO32-+H2O | |
| B�� | Cl2ͨ��ˮ�У�Cl2+H2O�T2H++Cl-+ClO- | |
| C�� | ���Ȼ�����Һ��ʴӡˢ��·���ϵ�ͭ��Fe3++Cu�TFe2++Cu2+ | |
| D�� | �������ᱵ�����м���ϡ���3BaSO3+2H++2NO3-�T3BaSO4��+2NO��+H2O |
| A�� | �μӼ����Լ��Ժ�ɫ����Һ�У�Na+��Fe2+��Cl-��NO3- | |
| B�� | [H+]=10-12 mol•L-1����Һ��K+��Ba2+��Cl-��Br- | |
| C�� | [OH-]/[H+]=1012����Һ�У�NH4+��Al3+��NO3-��CO32- | |
| D�� | ��ˮ�����[H+]=1.0��10-13 mol•L-1����Һ�У�K+��NH4+��[Al��OH��4]-��HCO3- |
| A�� | Ŀǰ��ҵ�ϳ��õ�������Ȼ��Ʒ����ƣ����ʱ������������ | |
| B�� | �������CaCl2ʱ������������������ | |
| C�� | ���õ�ⱥ��MgCl2��Һ�ķ�����ý���þ | |
| D�� | �������Al2O3�Ʊ�������ʱ��Ҫ�������ʯ��ʹAl2O3�ڽϵ��¶����۽� |
| A�� | AgNO3��Na2CO3��HNO3 | B�� | Na2CO3��AgNO3��HNO3 | ||
| C�� | AgNO3��K2CO3��HNO3 | D�� | AgNO3��Na2CO3��HCl |
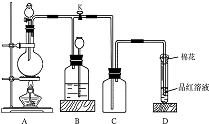 ��ͼ��ʾװ��Ϊͭ��Ũ���ᷴӦ��ȡ���������ʵ��װ�ã���ش��������⣺
��ͼ��ʾװ��Ϊͭ��Ũ���ᷴӦ��ȡ���������ʵ��װ�ã���ش��������⣺