题目内容
3.将一定量金属铜溶于50mL11.0mol/L的浓硝酸中,待铜完全溶解后,收集到气体4.48L(标准状况),并测得溶液中氢离子浓度为1.0mol/L.假设反应后溶液的体积仍为50mL.试计算:(1)被还原的硝酸的物质的量;
(2)铜的质量.
分析 (1)被还原的硝酸生成NO2或NO2、NO混合物,根据N原子守恒可知,被还原的n(HNO3)=n(NO2+NO);
(2)反应中硝酸有剩余,根据氢离子计算剩余硝酸物质的量,再根据N元素守恒计算Cu(NO3)2的物质的量,根据Cu元素守恒计算Cu的质量.
解答 解:(1)被还原的硝酸生成NO2或NO2、NO混合物,根据N原子守恒可知,故被还原的n(HNO3)=n(气体)=4.48 L÷22.4L•mol-1=0.20mol,
答:被还原的硝酸的物质的量为0.2mol;
(2)剩余的n(HNO3)=1.0 mol•L-1×0.05L=0.05 mol,
根据N元素守恒,可知0.05mol+0.2mol+2n[Cu(NO3)2]=11.0 mol•L-1×0.050L,
解得n[Cu(NO3)2]=0.15mol,
故m(Cu)=0.15mol×64g.mol-1=9.6g,
答:Cu的质量为9.6g.
点评 本题考查化学方程式计算、氧化还原反应计算,难度中等,注意反应中硝酸起氧化剂、还原剂作用,注意守恒思想的应用.

练习册系列答案
相关题目
4.化学与生活密切相关,下列有关说法正确的是( )
| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | 糖类、蛋白质、油脂属于天然高分子化合物 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的消毒净化 |
5.下列离子方程式正确的是( )
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu═Fe2++Cu2+ | |
| D. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
18.下列说法正确的是( )
| A. | 凡金属元素与非金属元素之间都形成离子键 | |
| B. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| C. | 含有离子键的化合物中,也可能还含有共价键 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |
15.常温下,下列各组离子一定能大量共存的是( )
| A. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | [H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | [OH-]/[H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、[Al(OH)4]-、HCO3- |
13.对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法.下列有关说法中正确的是( )
| A. | 目前工业上常用电解熔融氯化钠法制钠,电解时可用铁作阳极 | |
| B. | 电解熔融CaCl2时,金属钙在阳极生成 | |
| C. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| D. | 电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解 |

 .
.
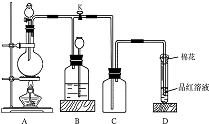 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题: