题目内容
17.环境问题已成为社会关注的焦点.(1)某农药厂排放的废水中常含有较多的NH4+和PO43-,可在该废水中加入镁矿工业废水来除去这些离子.反应式为:Mg2+(aq)+NH4+(aq)+PO43-(aq)?MgNH4PO4(s),该方法中需要控制污水的pH为7.5~10,若pH高于10.7,则固体产品的产量会大大降低.其原因可能为当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动.
(2)请说出该固体产品的一种用途为可做化肥.
分析 (1)若pH高于10.7,固体产品的产量会大大降低,可能是溶液中的Mg2+、NH4+会与OH-反应;
(2)MgNH4PO4可做化肥,补充N、P、Mg等元素.
解答 解:(1)若pH高于10.7,固体产品的产量会大大降低,可能是溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动;
故答案为:当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动;
(2)MgNH4PO4可做化肥,补充N、P、Mg等元素;
故答案为:可做化肥.
点评 本题考查沉淀溶解平衡的移动,难度中等,需要学生具备扎实的基础与灵活运用能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
18.H2O2可作脱氯剂,除去氯气的不良影响,方程式如下:H2O2+Cl2=2HCl+O2.以下推断正确的是( )
| A. | 该反应为置换反应 | B. | 每生成1mol O2转移4mol e- | ||
| C. | H2O2被还原 | D. | 反应后溶液pH值升高 |
5.下列反应的离子方程式正确且表示复分解反应的是( )
| A. | 钠跟水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | 碳酸氢钙溶液加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 碳酸氢钠溶液中加入盐酸:HCO3-+H+═CO2↑+H2O |
2.用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol•L-1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下:
(1)达到滴定终点的时溶液颜色的变化为无色到浅红色;
(2)根据以上数据可以计算出盐酸的物质的量浓度为0.1448mol/L;
(3)以下操作造成测定结果偏高的原因可能是CD.
A、滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、未用标准液润洗碱式滴定管.
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.40mL | 18.50mL |
| 第二次 | 1.30mL | 18.05mL |
| 第三次 | 3.10mL | 21.20mL |
(2)根据以上数据可以计算出盐酸的物质的量浓度为0.1448mol/L;
(3)以下操作造成测定结果偏高的原因可能是CD.
A、滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、未用标准液润洗碱式滴定管.
6.下列有机物的命名正确的是( )
| A. | 1-甲基戊烷 | B. | 2,3-二甲基戊烷 | C. | 3-戊烯 | D. | 3,4-二甲基戊烷 |
 .
.
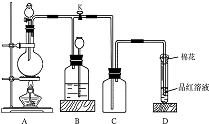 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:

 下列各组物质中,满足下图物质一步转化关系的选项是( )
下列各组物质中,满足下图物质一步转化关系的选项是( )