题目内容
3.下列说法中正确的是( )| A. | 丙烯分子中有8个σ键,1个π键 | |
| B. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| C. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 | |
| D. | NCl3和BC13分子中,中心原子都采用sp3杂化 | |
| E. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
分析 A.根据结构简式CH3-CH=CH2判断;
B.SiO2晶体中,每个Si原子形成4个共价键;
C.NH3分子间有氢键,沸点较高;
D.NCl3中N形成3个σ键,孤电子对数=1,为SP3杂化,BCl3中B形成3个σ键,无孤电子对,为sp2杂化;
E.根据冰→水→水蒸气的过程为物理变化,破坏的是分子间作用力,主要是氢键,水蒸气→氧气和氢气是化学变化,破坏的是化学键,为极性键
解答 解:A.结构简式为CH3-CH=CH2,C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键和1个π键,故A正确;
B.SiO2晶体中,每个Si原子形成4个共价键,1个O原子和2个Si原子形成2个共价键,故B错误;
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3分子间只有范德华力,故C正确;
D.NCl3中N形成3个σ键,孤电子对数=$\frac{5-3×1}{2}$=1,为SP3杂化,BCl3中B形成3个σ键,无孤电子对,为sp2杂化,故D错误;
E.固态水中和液态水中含有氢键,当冰→水→水蒸气主要是氢键被破坏,但属于物理变化,共价键没有破坏,水蒸气→氧气和氢气,为化学变化,破坏的是极性共价键,故E错误.
故选AC.
点评 本题综合考查了共价键的形成和共价键的种类、杂化方式和类型、晶体的微粒间作用,综合性较强,难度一般,注意基础知识的积累.

练习册系列答案
相关题目
14.设v(正)和v(逆)分别表示可逆反应的正反应速率和逆反应速率.在一定温度下可逆反应N2+3H2$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3达到平衡时( )
| A. | V(逆)>V(正) | B. | V(逆)<V(正) | ||
| C. | V(逆)>V(正),正逆反应停止 | D. | V(逆)=V(正),正逆反应仍进行 |
11.下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)>c(NH${\;}_{4}^{+}$) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| C. | 在NaHA溶液中(H2A为弱酸):c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(OH-)=c(H+) |
8.0.1mol NaHCO3中含有( )
| A. | 0.2mol Na+ | B. | 0.05mol CO${\;}_{3}^{2-}$ | ||
| C. | 6.02×1023个O | D. | 0.1mol H |
15.化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质.这些常见的化合物与单质之间存在如图关系(已知化合物C是一种有机物),

以下结论不正确的是( )

以下结论不正确的是( )
| A. | 甲、乙、丙三种单质全是非金属 | |
| B. | 上述转化关系所涉及的化合物中有一种是电解质 | |
| C. | 上图所示的五个转化关系中,有三个是化合反应 | |
| D. | 上图所示的五个转化关系中,均为放热反应 |
 有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示:
有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示: +CaCl2+2H2O.
+CaCl2+2H2O.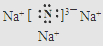 .
.