题目内容
10.已知:①:2C(s)+O2(g)═2CO(q)△H=-221.0kJ/mol②2H2(q)+O2(q)═2H2O(g)△H=-483.6kJ/mol,则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )| A. | 262.6kJ/mol | B. | -131.3kJ/mol | C. | -352.3kJ/mol | D. | +131.3kJ/mol |
分析 依据热化学方程式和盖斯定律计算得到反应焓变与起始和终了状态有关,与变化过程无关.
解答 解:①2C(s)+O2(g)═2CO(g);△H=-221.0KJ/mol
②2H2(g)+O2(g)═2H2O;△H=-483.6KJ/mol
依据盖斯定律$\frac{①-②}{2}$得到 C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ/mol;
故选D.
点评 本题考查热化学方程式和盖斯定律计算,掌握基础是关键,题目较简单.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
1.下列有关实验原理或操作正确的是( )
| A. | 用湿润的pH试纸来测溶液的pH | |
| B. | 用四氯化碳萃取溴的苯溶液中的溴 | |
| C. | 实验室将硫酸铜溶液直接加热蒸干来制取CuSO4•5H2O | |
| D. | 用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
18.下列离子方程式不正确的是( )
| A. | 足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-═2I2+2H2O | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 碳酸氢镁溶液中加入足量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O |
5.下列离子方程式书写正确的是( )
| A. | 用Pt电极电解少量的MgC12溶液:2H2O+2Cl- $\frac{\underline{\;通电\;}}{\;}$H2↑+C12↑+2OH- | |
| B. | 明矾溶液中加入Ba(OH)2溶液至生成的沉淀的质量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O | |
| C. | 向含有4 mol FeBr2的溶液中通入3 mol Cl2充分反应:2Fe2++4Br-+3Cl2═4Fe3++6Cl-+Br2 | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O |
2.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2与盐酸,Cu(OH)2与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液,Ba(OH)2溶液与H2SO4溶液 | |
| C. | NaHCO3溶液与NaHSO4溶液,NaHCO3溶液与盐酸 | |
| D. | 石灰石与稀硝酸反应,生石灰与稀盐酸 |
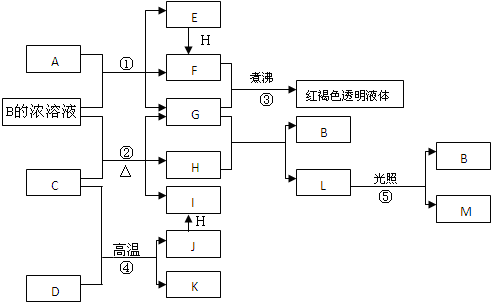
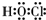 .反应②的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
.反应②的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.