题目内容
18.下列离子方程式不正确的是( )| A. | 足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-═2I2+2H2O | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 碳酸氢镁溶液中加入足量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O |
分析 A.二价铁离子还原性强于溴离子,氯气少量先氧化二价铁离子;
B.氧气能够氧化碘离子生成单质碘;
C.发生氧化还原反应生成硫酸钙;
D.二者反应生成氢氧化镁、碳酸钙沉淀和水.
解答 解:A.足量的溴化亚铁和少量的氯气反应,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故A正确;
B.向KI与稀硫酸的混合溶液中通入氧气,离子方程式:4H++O2+4I-═2I2+2H2O,故B正确;
C.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+,故C错误;
D.碳酸氢镁溶液中加入足量的澄清石灰水,离子方程式:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O,故D正确;
故选:C.
点评 本题考查了离子方程式的书写,为高频考点,把握发生反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应,注意溴离子与二价铁离子还原性强弱.

练习册系列答案
相关题目
8.对于反应:A+B=C下列条件的改变一定能使化学反应速率加快的是( )
| A. | 增加A的物质的量 | B. | 升高体系温度 | ||
| C. | 增加体系压强 | D. | 减少C的物质的量浓度 |
9.下列叙述中正确的是( )
| A. | 常温常压下,含有NA个原子的氦气体积约为22.4L | |
| B. | 常温常压下,O2和O3的混合物16g中约含有6.02×1023个氧原子 | |
| C. | 6.4g SO2中含有的原子数为0.2NA | |
| D. | 等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
6.下列说法正确的是( )
| A. | HCl属于共价化合物,溶于水能电离出H+和Cl- | |
| B. | NaOH是离子化合物,该物质中只含离子键 | |
| C. | HI气体受热分解的过程中,只需克服分子间作用力 | |
| D. | 石英和干冰均为原子晶体 |
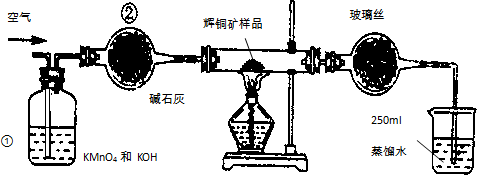
3. 工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作:
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作:
A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2═SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.
试回答下列问题:
(1)装置①的作用是除去空气中可能含有的SO2等气体;装置②的作用是干燥气体.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O;
(3)若操作F的滴定结果如表所示,则辉铜矿样品中Cu2S的质量分数是80%.
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是(写一种即可):在KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低.
(5)已知在常温下FeS 的Ksp=6.25×10-18,H2S 饱和溶液中c(H+)与c(S${\;}_{2}^{-}$)之间存在如下关系:c2(H+)•c(S2-)=1.0×10-22.在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H+)为4×10-3mol/L.
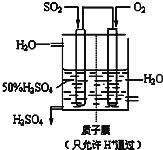
(6)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.
 工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作:
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作:A.连接全部仪器,使其成为如图装置,并检查装置的气密性.
B.称取研细的辉铜矿样品1.000g.
C.将称量好的样品小心地放入硬质玻璃管中.
D.以每分钟1L的速率鼓入空气.
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2═SO2+2Cu.
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点.按上述操作方法重复滴定2-3次.

试回答下列问题:
(1)装置①的作用是除去空气中可能含有的SO2等气体;装置②的作用是干燥气体.
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O;
(3)若操作F的滴定结果如表所示,则辉铜矿样品中Cu2S的质量分数是80%.
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)已知在常温下FeS 的Ksp=6.25×10-18,H2S 饱和溶液中c(H+)与c(S${\;}_{2}^{-}$)之间存在如下关系:c2(H+)•c(S2-)=1.0×10-22.在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H+)为4×10-3mol/L.
(6)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式SO2-2e-+2H2O=SO42-+4H+.
10.已知:①:2C(s)+O2(g)═2CO(q)△H=-221.0kJ/mol②2H2(q)+O2(q)═2H2O(g)△H=-483.6kJ/mol,则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
| A. | 262.6kJ/mol | B. | -131.3kJ/mol | C. | -352.3kJ/mol | D. | +131.3kJ/mol |
