题目内容
2.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )| A. | Cu(OH)2与盐酸,Cu(OH)2与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液,Ba(OH)2溶液与H2SO4溶液 | |
| C. | NaHCO3溶液与NaHSO4溶液,NaHCO3溶液与盐酸 | |
| D. | 石灰石与稀硝酸反应,生石灰与稀盐酸 |
分析 A.盐酸为强酸,醋酸为弱酸;
B.BaCl2溶液与Na2SO4溶液反应实质是钡离子与硫酸根离子反应生成沉淀,Ba(OH)2溶液与H2SO4溶液反应实质钡离子与硫酸根离子反应生成沉淀,氢离子与氢氧根离子反应生成水;
C.反应实质都是碳酸氢根离子与氢离子反应;
D.石灰石为碳酸钙,生石灰为氧化钙.
解答 解:A.盐酸为强酸,书写时应拆成离子形式,醋酸为弱酸,书写时应保留化学式,所以二者不能用同一个离子方程式表示,故A错误;
B.BaCl2溶液与Na2SO4溶液反应实质是钡离子与硫酸根离子反应生成沉淀,Ba(OH)2溶液与H2SO4溶液反应实质钡离子与硫酸根离子反应生成沉淀,氢离子与氢氧根离子反应生成水,二者反应实质不同,不能用同一个离子方程式表示,故B错误;
C.NaHCO3溶液与NaHSO4溶液,NaHCO3溶液与盐酸,反应实质都是碳酸氢根离子与氢离子反应,能够用离子方程式:HCO3-+H+=H2O+CO2↑表示,故C正确;
D.石灰石为碳酸钙,生石灰为氧化钙,反应实质不同,不能用同一个离子方程式表示,故D错误;
故选:C.
点评 本题考查离子方程式正误判断,明确物质的性质及离子方程式书写规则即可解答,注意化学式的拆分,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5待测试样的c(H+)=1×10-4mol•L-1.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3
c.CaCl2 d.NaHSO3
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3
c.CaCl2 d.NaHSO3
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
10.已知:①:2C(s)+O2(g)═2CO(q)△H=-221.0kJ/mol②2H2(q)+O2(q)═2H2O(g)△H=-483.6kJ/mol,则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
| A. | 262.6kJ/mol | B. | -131.3kJ/mol | C. | -352.3kJ/mol | D. | +131.3kJ/mol |
17.用pH大小表示溶液的酸碱性相对强弱有许多不足之处.因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].常温下,在AG=10的溶液中能大量共存的离子是( )
| A. | Ca2+、K+、Cl-、SO32- | B. | NH4+、Fe2+、I-、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |
14.下列反应的离子方程式中,正确的是( )
| A. | 氯水与足量的 FeBr2溶液反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| B. | NaHCO3溶液与 NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| C. | NaHCO3溶液与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | NaHCO3溶液与CaCl2;溶液反应:CO32-+Ca2+=CaCO3↓ |
1.下列各物质按所含原子数由大到小顺序排列的是( )
①0.3molNH3
②标准状况下的22.4L氯气
③9mLH2O(4℃)
④0.2mol磷酸.
①0.3molNH3
②标准状况下的22.4L氯气
③9mLH2O(4℃)
④0.2mol磷酸.
| A. | ①④③② | B. | ④③②① | C. | ②④③① | D. | ①④②③ |

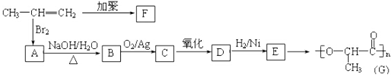
 .
.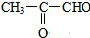 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O.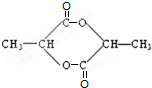 .
.