题目内容
5.下列离子方程式书写正确的是( )| A. | 用Pt电极电解少量的MgC12溶液:2H2O+2Cl- $\frac{\underline{\;通电\;}}{\;}$H2↑+C12↑+2OH- | |
| B. | 明矾溶液中加入Ba(OH)2溶液至生成的沉淀的质量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O | |
| C. | 向含有4 mol FeBr2的溶液中通入3 mol Cl2充分反应:2Fe2++4Br-+3Cl2═4Fe3++6Cl-+Br2 | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O |
分析 A.镁离子与电解生成的氢氧根离子结合生成氢氧化镁沉淀;
B.硫酸根离子完全反应时生成的沉淀质量最大,此时铝离子与氢氧根离子恰好反应生成偏铝酸根离子;
C.亚铁离子的还原性大于溴离子,氯气不足时亚铁离子优先反应,属于的氯气再与溴离子反应;
D.醋酸为弱酸,离子方程式中醋酸不能拆开.
解答 解:A.用Pt电极电解氯化镁溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气和氢氧根离子,企业改革离子与镁离子结合生成氢氧化镁沉淀,正确的离子方程式为:Mg2++2H2O+2Cl- $\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑+Mg(OH)2↓,故A错误;
B.明矾溶液中加入Ba(OH)2溶液至生成的沉淀的质量最多,铝离子与氢氧根离子的物质的量之比为1:4,二者反应生成偏铝酸根离子,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故B正确;
C.向含有4 mol FeBr2的溶液中通入3 mol Cl2充分反应,亚铁离子优先被氧化,4mol亚铁离子完全反应消耗2mol氯气,剩余的1mol氯气能够氧化2mol溴离子,则参加反应的亚铁离子和溴离子的物质的量之比为2:1,属于正确的离子方程式为:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2,故C错误;
D.碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

| A. | 观察KCl溶液没有颜色 | |
| B. | 加水稀释后FeCl3溶液黄色变浅 | |
| C. | 向FeCl3溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液黄色未消失 | |
| D. | 向FeCl3溶液中滴加适量氢氧化钠溶液,振荡后静置,溶液黄色消失 |
①生成物的百分含量一定增加
②反应物转化率一定增大
③生成物的产量一定增加
④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
| A. | ①② | B. | ②⑤ | C. | ③⑤ | D. | ④⑥ |
| A. | 262.6kJ/mol | B. | -131.3kJ/mol | C. | -352.3kJ/mol | D. | +131.3kJ/mol |
| A. | Ca2+、K+、Cl-、SO32- | B. | NH4+、Fe2+、I-、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |
| A. | 氯水与足量的 FeBr2溶液反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| B. | NaHCO3溶液与 NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| C. | NaHCO3溶液与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | NaHCO3溶液与CaCl2;溶液反应:CO32-+Ca2+=CaCO3↓ |
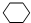 ,名称是环己烷,该烃的二氯代物有4种.
,名称是环己烷,该烃的二氯代物有4种.