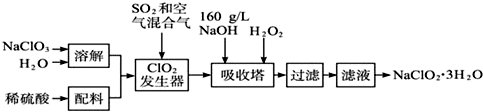
��Ŀ����
15����֪D��M��H�dz����÷ǽ������ʣ�����M����ɫ���壬H����ɫ���壮J��һ�ֽ������ʣ���ͬ���ij��Ԫ�����γɻ�������������Ԫ�أ���A��C�ǽ��������C��J����ij�ֳ�����صĵ缫���ϣ�JԪ�ص�+2�ۻ������+4�ۻ������ȶ���B��C��Ӧʱ��ÿ����1molHͬʱ����4molB��1molC��Kֻ֪����CO��CO2�е�һ�ֻ����֣����ǹ�ϵ��ͼ��ʾ��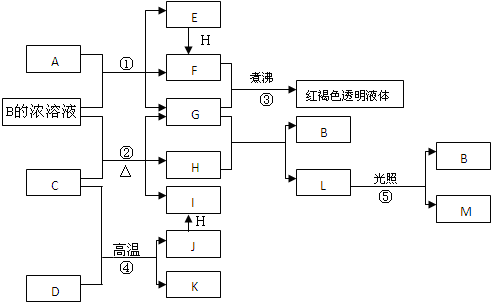
��1��д��A��������������Ԫ�������ڱ��е�λ�ã��������ڵڢ��壮
��2��д��������L�ĵ���ʽ��
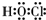 ����Ӧ�ڵĻ�ѧ����ʽΪPbO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$PbCl2+Cl2��+2H2O��
����Ӧ�ڵĻ�ѧ����ʽΪPbO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$PbCl2+Cl2��+2H2O����3����ͼ�еĺ��ɫ��Һ������ε���HI��Һ�����Թ۲쵽�Ȳ������ɫ����������ɫ�����ܽ⣬���ɫ�����ܽ�����ӷ���ʽΪ2Fe��OH��3+2I-+6H+=I2+2Fe2++6H2O��
��4���ɽ���������A��C�õ�����Ӧ�Ľ�������ұ��ҵ��һ����â٣�����ţ�����
���Ȼ�ԭ�� �ڵ�ⷨ ���ȷֽⷨ
���д�A�õ�����Ӧ����Ҳ�������ȷ�������Ӧ��1molA�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ8mol��
��5����C��J���缫�������ṹ����ͼ��ʾԭ��أ������ĵ缫��ӦΪPb+SO42--2e-=PbSO4������Ӧת��2mol����ʱ��������������96�ˣ�

���� J��һ�ֽ������ʣ���ͬ���ij��Ԫ�����γɻ�������������Ԫ�أ�Ϊ�ڢ�A�壬JԪ�ص�+2�ۻ������+4�ۻ������ȶ���C��J����ij�ֳ�����صĵ缫���ϣ��ƶ�JΪPb��H��Ԫ����ɫ����ǽ������ʣ���HΪCl2����J+H=I�����ж�IΪPbCl2��A��C�ǽ����������CΪPbO2�����C+D=J+CO2��Ӧ��̼��PbO2�ķ�Ӧ����DΪC��
��F+G��еõ����ɫҺ�壬֤�����ɵ��������������壬��E+H=F��A+B=E+F+G�����ƶ�EΪFeCl2��FΪFeCl3��GΪH2O��BΪHCl��AΪFe3O4������G+H=B+L����֪LΪHClO����MΪO2��B��C��Ӧʱ��ÿ����1molHͬʱ����4molB��1molC��������Ӧ��PbO2+4HCl=2H2O+Cl2��+PbCl2���ݴ˽��
��� �⣺J��һ�ֽ������ʣ���ͬ���ij��Ԫ�����γɻ�������������Ԫ�أ�Ϊ�ڢ�A�壬JԪ�ص�+2�ۻ������+4�ۻ������ȶ���C��J����ij�ֳ�����صĵ缫���ϣ��ƶ�JΪPb��H��Ԫ����ɫ����ǽ������ʣ���HΪCl2����J+H=I�����ж�IΪPbCl2��A��C�ǽ����������CΪPbO2�����C+D=J+CO2��Ӧ��̼��PbO2�ķ�Ӧ����DΪC��
��F+G��еõ����ɫҺ�壬֤�����ɵ��������������壬��E+H=F��A+B=E+F+G�����ƶ�EΪFeCl2��FΪFeCl3��GΪH2O��BΪHCl��AΪFe3O4������G+H=B+L����֪LΪHClO����MΪO2��B��C��Ӧʱ��ÿ����1molHͬʱ����4molB��1molC��������Ӧ��PbO2+4HCl=2H2O+Cl2��+PbCl2��
��1��A���ʵĻ�ѧʽΪ��Fe3O4��Fe��Ԫ�����ڱ��е�λ���ǵ������ڵڢ��壬�ʴ�Ϊ���������ڵڢ��壻
��2��LΪHClO�������ʽΪ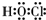 ����Ӧ����HCl��PbO2��Ӧʱ��ÿ����1molCl2ͬʱ����4molHCl��1molPbO2����ѧ����ʽΪ��PbO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$PbCl2+Cl2��+2H2O��
����Ӧ����HCl��PbO2��Ӧʱ��ÿ����1molCl2ͬʱ����4molHCl��1molPbO2����ѧ����ʽΪ��PbO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$PbCl2+Cl2��+2H2O��
�ʴ�Ϊ��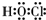 ��PbO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$PbCl2+Cl2��+2H2O��
��PbO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$PbCl2+Cl2��+2H2O��
��3��������������������ε���HI��Һ����ʼ������кͽ��彺��������ɣ���������۳����õ�������������������HI������������������кͷ�Ӧ���������������������ɵ⣬���ɫ�����ܽ�����ӷ���ʽΪ��2Fe��OH��3+2I-+6H+=I2+2Fe2++6H2O��
�ʴ�Ϊ��2Fe��OH��3+2I-+6H+=I2+2Fe2++6H2O��
��4���ɽ���������AΪFe3O4��CΪPbO2 �õ�����Ӧ�Ľ���ΪFe��Pb�����ݽ����˳����ұ��ҵ��һ������Ȼ�ԭ�������д�A�õ�����Ӧ����Ҳ�������ȷ��������ķ�ӦΪ��3Fe3O4+8Al $\frac{\underline{\;����\;}}{\;}$9Fe+4Al2O3������Ӧ��1molA�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ8mol��
�ʴ�Ϊ���٣�8��
��5����PbO2��Pb���缫�������ṹ����ͼ��ʾ�����Ǧ���أ�����ΪPbO2���缫��ӦΪ��PbO2+2e-+4H++SO42-�TPbSO4+2H2O������ΪPb���缫��ӦΪ��Pb+SO42--2e-=PbSO4������Ӧת��2mol����ʱ��������Ӧ1molPb��������=1mol��207.2g/mol=207.2g������1molPbSO4��������=1mol��303.2g/mol=303.2g���ʸ�����������=303.2g-207.2g=96g��
�ʴ�Ϊ��Pb+SO42--2e-=PbSO4��96��
���� ���⿼��Ԫ�������ƶϣ����ʵ���ɫ��JΪ��صĵ缫���ϼ�ͬ����Ԫ���γɻ���������ˮ�ƶ�ͻ�ƿڣ��ٽ��ת����ϵ�ƶϣ���Ҫѧ����������Ԫ�ػ��������ʣ��Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | 0.3 mol | B�� | 0.1 mol | C�� | 0.2 mol | D�� | 2 mol |
| A�� | HCl���ڹ��ۻ��������ˮ�ܵ����H+��Cl- | |
| B�� | NaOH�����ӻ������������ֻ�����Ӽ� | |
| C�� | HI�������ȷֽ�Ĺ����У�ֻ��˷����Ӽ������� | |
| D�� | ʯӢ�ɱ���Ϊԭ�Ӿ��� |
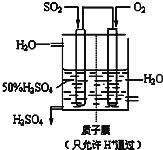 ��ҵ��Ϊ�˲ⶨ��ͭ����Ҫ�ɷ���Cu2S����Cu2S�������������������ͼװ�ã�ʵ��ʱ�����²��������
��ҵ��Ϊ�˲ⶨ��ͭ����Ҫ�ɷ���Cu2S����Cu2S�������������������ͼװ�ã�ʵ��ʱ�����²��������A������ȫ��������ʹ���Ϊ��ͼװ�ã������װ�õ������ԣ�
B����ȡ��ϸ�Ļ�ͭ����Ʒ1.000g��
C���������õ���ƷС�ĵط���Ӳ�ʲ������У�
D����ÿ����1L�����ʹ��������
E����Ӳ�ʲ������еĻ�ͭ����Ʒ���ȵ�һ���¶ȣ�������ӦΪ��Cu2S+O2�TSO2+2Cu��
F����ȡ25.00ml��SO2��ˮ��Һ��250ml��ƿ�У���0.0100mol/L KMnO4����Һ�ζ����յ㣮���������������ظ��ζ�2-3�Σ�
�Իش��������⣺
��1��װ�âٵ������dz�ȥ�����п��ܺ��е�SO2�����壻װ�âڵ������Ǹ������壮
��2���ٶ���ͭ���е���ȫ��ת��ΪSO2������ȫ����ˮ���գ������F����������Ӧ�Ļ�ѧ����ʽΪ2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O��
��3��������F�ĵζ���������ʾ�����ͭ����Ʒ��Cu2S������������80%��
| �ζ� ���� | ������Һ�� ���/mL | ����Һ����� | |
| �ζ�ǰ�̶�/mL | �ζ���̶�/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
��5����֪�ڳ�����FeS ��Ksp=6.25��10-18��H2S ������Һ��c��H+����c��S${\;}_{2}^{-}$��֮��������¹�ϵ��c2��H+��•c��S2-��=1.0��10-22���ڸ��¶��£������� FeS Ͷ�����ⱥ����Һ�У���ʹ��Һ�У�Fe2+��Ϊ lmol/L��Ӧ������Һ��c��H+��Ϊ4��10-3mol/L��
��6��ij����������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2�ĵ缫�ĵ缫��ӦʽSO2-2e-+2H2O=SO42-+4H+��
| A�� | 262.6kJ/mol | B�� | -131.3kJ/mol | C�� | -352.3kJ/mol | D�� | +131.3kJ/mol |
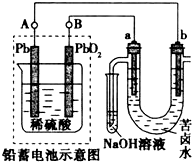 ��Ǧ���ص���±ˮ����C1-��Br-��Na+��Mg2+����װ����ͼ��ʾ��a��bΪʯī�缫��������˵������ȷ���ǣ�������
��Ǧ���ص���±ˮ����C1-��Br-��Na+��Mg2+����װ����ͼ��ʾ��a��bΪʯī�缫��������˵������ȷ���ǣ�������| A�� | Ǧ���طŵ�ʱ���õ��������������С | |
| B�� | Ǧ���س��ʱ��B��Ӧ�����Դ�������� | |
| C�� | ����±ˮʱ��a�缫���ȷŵ����Cl-������Br-����ΪCl-�Ļ�ԭ��ǿ��Br- | |
| D�� | ��b������0.01 mol ����ʱ��Ǧ����������0.02 molH2SO4 |

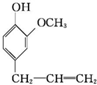 �����������ƿ���ܰ���㾫�Լ����춡��Ӻ������صȣ��ϳɶ�����ӵ�һ��·�����£�
�����������ƿ���ܰ���㾫�Լ����춡��Ӻ������صȣ��ϳɶ�����ӵ�һ��·�����£�
 ��X����±��ԭ�ӣ���
��X����±��ԭ�ӣ��� ��
�� ��
�� ��
��