题目内容
7.已知反应2SO2+O2?2SO3,下列判断正确的是( )| A. | 2 mol SO2和足量O2反应,必定生成2 mol SO3 | |
| B. | 平衡时,SO2消耗速率必定等于O2生成速率的两倍 | |
| C. | 其他条件不变,增大压强,平衡必定向正反应方向移动 | |
| D. | 平衡时,SO2浓度必定等于O2浓度的两倍 |
分析 A.反应为可逆反应,反应物不能完全转化;
B.当正逆反应速率相等时,化学反应达到平衡状态;
C.如果通入惰性气体,压强增大,但平衡不移动;
D.平衡时的浓度大小取决于起始配料比以及转化的程度,不能确定.
解答 解:A.反应为可逆反应,反应物不能完全转化,2体积SO2和足量O2反应,生成SO3的体积小于2体积,故A错误;
B.正逆反应速率相等时,化学反应达到平衡状态,则SO2消耗速率等于O2生成速率的两倍时达到平衡状态,故B正确;
C.其他条件不变,缩小体积,压强增大,平衡必定向右移动,故C错误;
D.平衡时的浓度大小取决于起始配料比以及转化的程度,平衡时,SO2浓度与O2浓度的浓度关系不确定,不能作为判断是否达到平衡的依据,故D错误.
故选B.
点评 本题考查化学平衡状态的判断以及影响平衡的因素,题目难度不大,本题注意把握化学平衡的特征,易错点为C,注意引起压强增大的因素与反应物浓度的关系.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
18.下列物质中的离子键最强的是( )
| A. | KCl | B. | CaCl2 | C. | MgO | D. | Na2O |
15.下列表示物质结构的化学用语或模型图正确的是( )
| A. | 二氧化碳的电子式: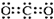 | B. | 14C的原子结构示意图: | ||
| C. | C3H8的结构式CH3-CH2-CH3 | D. | 次氯酸的电子式: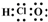 |
19. 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
据此可判断( )
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
| A. | a<b | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | 上述反应是放热反应 |
1.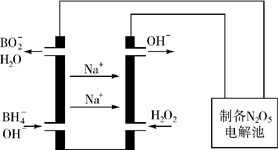 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g)△H1=+44.0kJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=+229.3kJ•mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H4,则△H4=-2317.0kJ•mol-1.
(2)亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
(3)一定温度下,将a mol/L的氨水与b mol/LH2SO4溶液等体积混合,充分反应后有:2c(SO42-)=c(NH4+),用含a和b的代数式表示该混合溶液中NH3•H2O的电离常数为$\frac{2b}{a-2b}$×10-7.
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体,写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
(5)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g)△H1=+44.0kJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=+229.3kJ•mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H4,则△H4=-2317.0kJ•mol-1.
(2)亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
(3)一定温度下,将a mol/L的氨水与b mol/LH2SO4溶液等体积混合,充分反应后有:2c(SO42-)=c(NH4+),用含a和b的代数式表示该混合溶液中NH3•H2O的电离常数为$\frac{2b}{a-2b}$×10-7.
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体,写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
(5)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
2.利用金属的活泼性不同,冶炼铝、铁、银分别应采用的方法是( )
| A. | 电解法、热还原法、热分解法 | B. | 热还原法、热分解法、电解法 | ||
| C. | 热分解法、热还原法、电解法 | D. | 电解法、热分解法、热还原法 |

 C的离子结构示意图:
C的离子结构示意图: .
.