题目内容
12.如图所示为短周期的一部分,则A可能是(填元素符号)8,如果B原子和C原子的核外电子总数之和为A的4倍,则A的原子序数为O,B为(填元素符号,下同)P,C为Cl.画出A的原子结构示意图: C的离子结构示意图:
C的离子结构示意图: .
.
分析 图为短周期的一部分,由元素在周期表中的位置可知,A处于第二周期,B、C处于第三周期,令A的原子序数为x,则B、C的原子序数分别为x+7、x+9,B原子和C原子的核外电子总数之和为A的4倍,则x+7+x+9=4x,解得x=8,故A为氧元素、B为P、C为Cl,据此解答.
解答 解:图为短周期的一部分,由元素在周期表中的位置可知,A处于第二周期,B、C处于第三周期,令A的原子序数为x,则B、C的原子序数分别为x+7、x+9,B原子和C原子的核外电子总数之和为A的4倍,则x+7+x+9=4x,解得x=8,故A为氧元素、B为P、C为Cl,A的原子序数为8;A为O;B为P;C为Cl;A为O元素,原子结构示意图为 ;C为Cl元素,质子数为17,离子核外电子数为18,离子结构示意图为
;C为Cl元素,质子数为17,离子核外电子数为18,离子结构示意图为 ;故答案为:8;O,P,Cl;
;故答案为:8;O,P,Cl; ;
; .
.
点评 本题考查结构位置关系、原子结构示意图,难度不大,注意理解同主族元素原子序数关系.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
7.已知反应2SO2+O2?2SO3,下列判断正确的是( )
| A. | 2 mol SO2和足量O2反应,必定生成2 mol SO3 | |
| B. | 平衡时,SO2消耗速率必定等于O2生成速率的两倍 | |
| C. | 其他条件不变,增大压强,平衡必定向正反应方向移动 | |
| D. | 平衡时,SO2浓度必定等于O2浓度的两倍 |
17.在室温下,同规格的铝片分别与下列物质混合,化学反应速率最大的是( )
| A. | 18mol/L的浓硫酸15mL L | B. | 0.2mol/L的盐酸12mL | ||
| C. | 0.15mol/L的硫酸溶液8mL | D. | 0.1mol/L的盐酸15m |
6.下列有关热化学方程式的叙述正确的是( )
| A. | 若C(s)+O2(g)=CO2(g)△H1,CO2(g)+C(s)=2CO(g)△H2,2CO(g)+O2(g)=2CO2(g)△H3,则反应热的关系:△H1=△H2+△H3 | |
| B. | 若2H2(g)+O2(g)=2H2O(1)△H4,H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H5,则反应热的关系:△H4=△H5 | |
| C. | 若2SO2(g)+O2(g)=2SO3(g)△H<O,则物质的稳定性:SO2>SO3 | |
| D. | 若断裂1molH2(g)中的H-H键、断裂1 molO2(g)中的共价键分别需要吸收436 kJ、498 kJ的能量,生成H2O(g)中的1 mol H-O键能放出463kJ的能量,则2H2(g)+O2(g)=2H2O(g)△H=-482kJ.mol-1 |
 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: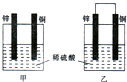 锌是一种较活泼的金属,具有广泛的用途.
锌是一种较活泼的金属,具有广泛的用途.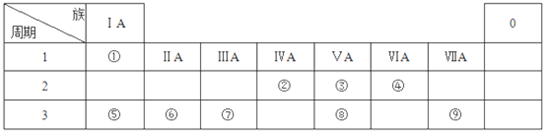
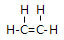 ;由④和⑥两种元素组成的化合物的电子式为
;由④和⑥两种元素组成的化合物的电子式为 ;元素⑨的原子结构示意图为
;元素⑨的原子结构示意图为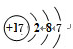 .
.