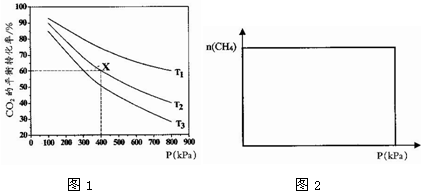
题目内容
2.氯气是一种重要的工业原料.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2Cl2↑+2H2O他们利用该反应设计如图所示制取氯气并验证其性质的实验.
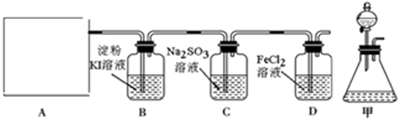
回答下列问题:
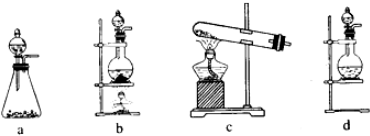
(1)该实验中A部分的装置是b (填标号).
(2)装置B中产生的现象为淀粉KI溶液变蓝.
(3)请设计实验验证装置C中的Na2SO3已被氧化取样,加HCl,再加入BaCl2溶液,若有白色沉淀生成,则原试样中Na2SO3已被氧化.
(4)写出D装置中发生反应的离子方程式2Fe2++Cl2═2Fe3++2Cl-.
(5)该实验存在明显的缺陷,请你提出改进的方法实验缺少尾气处理装置,应在D后增加一个盛有NaOH溶液的烧杯.
(6)若将上述装置改为制取SO2并分别验证SO2的漂白性、氧化性和还原性等性质.
B中品红溶液褪色,则说明产生的气体为SO2; C中Na2S溶液出现淡黄色沉淀;D中酸性KMnO4溶液或溴水溶液褪色,说明SO2有还原性.
分析 (1)依据反应物状态和反应条件选择发生装置;
(2)氯气与碘化钾反应生成碘单质,碘单质遇到淀粉变蓝;
(3)如果亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可;
(4)氯气与氯化亚铁反应生成氯化铁;
(5)氯气有毒,应进行尾气处理;
(6)检验二氧化硫应品红溶液;二氧化硫具有氧化性能够氧化硫离子生成单质硫;二氧化硫具有还原型,能够使酸性KMnO4溶液或溴水,据此解答.
解答 解:(1)依据化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2Cl2↑+2H2O,可知反应物为固体与液体加热条件下反应生成氯气,应选择装置b;
故答案为:b;
(2)氯气具有强的氧化性,氯气与碘化钾反应生成碘单质,碘单质遇到淀粉变蓝,所以看到现象为:淀粉KI溶液变蓝;
故答案为:淀粉KI溶液变蓝;
(3)如果亚硫酸钠被氧化,会生成硫酸钠,硫酸钠和氯化钡能发生 反应生成白色沉淀硫酸钡,亚硫酸钡也是沉淀,所以要先排除亚硫酸盐的干扰,再用氯化钡检验硫酸根离子,检验方法为:取样,加HCl,再加入BaCl2溶液,若有白色沉淀生成,则原试样中Na2SO3已被氧化;
故答案为:取样,加HCl,再加入BaCl2溶液,若有白色沉淀生成,则原试样中Na2SO3已被氧化;
(4)氯气与氯化亚铁反应生成氯化铁,离子方程式:2Fe2++Cl2═2Fe3++2 Cl-;
故答案为:2Fe2++Cl2═2Fe3++2 Cl-;
(5)氯气有毒,直接排放能够引起空气污染,应进行尾气处理,可以用氢氧化钠溶液吸收氯气;
故答案为:实验缺少尾气处理装置,应在D后增加一个盛有NaOH溶液的烧杯;
(6)二氧化硫具有漂泊性,能够使品红溶液褪色;
二氧化硫具有弱的氧化性,能够氧化硫离子生成单质硫,溶液出现淡黄色沉淀;二氧化硫具有还原型,能够使酸性KMnO4溶液或溴水;
故答案为:品红; 淡黄色沉淀; 酸性KMnO4溶液或溴水.
点评 本题考查了氯气的制备及性质的检验、二氧化硫性质的检验,熟悉氯气、二氧化硫的性质是解题关键,题目难度不大.

 ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )| A. | 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与6mol NaOH完全反应 | |
| C. | 在Ni催化下,1 mol 该物质可以和7mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
| A. | 甲烷分子的空间结构为正四面体,4条C-H键完全相同 | |
| B. | 甲烷可使澄清石灰水变浑浊 | |
| C. | 甲烷不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷与氯气在光照下可以发生取代反应 |
| A. | 2 mol SO2和足量O2反应,必定生成2 mol SO3 | |
| B. | 平衡时,SO2消耗速率必定等于O2生成速率的两倍 | |
| C. | 其他条件不变,增大压强,平衡必定向正反应方向移动 | |
| D. | 平衡时,SO2浓度必定等于O2浓度的两倍 |
(1)预测:根据已有知识和“氢铵”的名称,该小组预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐.
(2)实验和探究:
①NH4+的验证:取少量固体药品于试管中,然后滴加NaOH浓溶液,加热试管,将湿润的红色石蕊试纸置于试管口部,若红色石蕊试纸变蓝,则证明含NH4+.
②阴离子的探究:取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入图1装置.观察到的现象是溴水无明显变化,澄清石灰水变浑浊.再向滴加稀盐酸反应后的试管中加Ba(OH)2溶液,无明显现象.
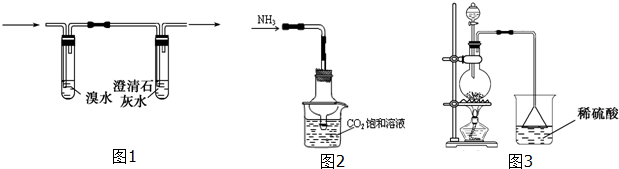
初步结论:“氢铵”是碳酸的铵盐.
③思考:上述实验步骤②加入Ba(OH)2溶液的目的是检验是否存在SO42-.根据初步实验结论,提出假设:
假设1:氢铵成分是NH4HCO3 假设2:氢铵成分是(NH4)2CO3
假设3:氢铵成分是(NH4)2CO3和NH4HCO3的混合物.
④根据上述假设,设计实验得出结论.限选试剂和仪器有:CaCl2溶液、品红溶液、Ba(NO3)2溶液、1.0mol/L盐酸、1.0mol•L-1 NaOH溶液、饱和澄清石灰水、BaCl2溶液、Ba(OH)2溶液、试管、胶头滴管
| 实验步骤 | 预期现象及结论 |
| 步骤1:取适量“氢铵”配制成溶液,取1~2ml试液于一支洁净的试管中,加足量BaCl2溶液,充分振荡. | ①若出现白色沉淀,证明氢铵中含有(NH4)2CO3; ②若没有明显现象可能含有NH4HCO3 |
| 步骤2:静置,取上层清液少许于另一试管中, 继续滴加滴加适量Ba(OH)2溶液,振荡观察现象. | 若出现白色沉淀,证明氢铵中含有NH4HCO3结合步骤1②,则假设1成立; 结合步骤1①,则假设3成立; 仅在步骤1中产生白色沉淀,则假设2成立;. |
①根据氢铵成分,设计小组根据下面实验装置来制备NH4HCO3是否合理否(填“是”或“否”)
②该实验小组设计了以下实验方案测定氢铵中的含氮量,请你阅读后进行评价:准确称取一定质量的样品,放入图2方案的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图3装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量).然后进行计算,可得化肥的含氮量.请你评价上述方案是否合理.若合理只需要说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
不合理,装置中没有干燥装置,稀硫酸吸收了较多水蒸气,误差太大;在烧杯前加一个装有碱石灰的干燥管.
| A. | 在相同温度下,Na2CO3比NaHCO3的溶解度小 | |
| B. | 可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 可用加热的方法除去Na2CO3中混有的NaHCO3杂质 | |
| D. | Na2CO3和NaHCO3固体分别与盐酸反应产生等量的CO2时,后者消耗的H+多 |