题目内容
15.下列表示物质结构的化学用语或模型图正确的是( )| A. | 二氧化碳的电子式: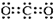 | B. | 14C的原子结构示意图: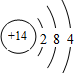 | ||
| C. | C3H8的结构式CH3-CH2-CH3 | D. | 次氯酸的电子式: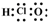 |
分析 A.二氧化碳属于共价化合物,分子中存在两个碳氧双键;
B.碳原子的原子序数=核外电子总数=6,最外层含有4电子;
C.结构式中需要将所有共价键用“-”表示,CH3-CH2-CH3为结构简式;
D.次氯酸的中心原子为O,其分子中不存在氢氯键.
解答 解:A.二氧化碳分子中含有两个碳氧双键,C、O原子最外层都达到8电子稳定结构,二氧化碳的电子式为: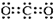 ,故A正确;
,故A正确;
B.14C的核电荷数、核外电子总数都是6,其原子结构示意图为: ,故B错误;
,故B错误;
C.CH3-CH2-CH3为丙烷的结构简式,丙烷的结构式为: ,故C错误;
,故C错误;
D.次氯酸为共价化合物,H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,则其电子式为: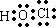 ,故D错误;
,故D错误;
故选A.
点评 本题考查了电子式、原子结构示意图、结构式与结构简式的判断,题目难度中等,注意掌握常见的化学用语的概念及正确表示方法,明确次氯酸的中心原子为O原子,为易错点.

练习册系列答案
相关题目
5.一定温度下,1mol X和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.说法正确是( )
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 amol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 |
6.一定条件下,在体积恒定的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g)△H<0.下列有关说法正确的是( )
| A. | 降低温度可以加快反应速率 | |
| B. | 达到化学反应限度时,生成2mol NH3 | |
| C. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 | |
| D. | 向容器中再加入N2可加快正反应速率 |
10.有一种有机化合物,其结构简式如图: ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )
 ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )| A. | 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与6mol NaOH完全反应 | |
| C. | 在Ni催化下,1 mol 该物质可以和7mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
7.已知反应2SO2+O2?2SO3,下列判断正确的是( )
| A. | 2 mol SO2和足量O2反应,必定生成2 mol SO3 | |
| B. | 平衡时,SO2消耗速率必定等于O2生成速率的两倍 | |
| C. | 其他条件不变,增大压强,平衡必定向正反应方向移动 | |
| D. | 平衡时,SO2浓度必定等于O2浓度的两倍 |
10.下列反应过程中的能量变化情况符合如图的是( )
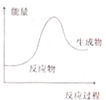

| A. | 乙醇的燃烧 | B. | 碳酸钙的分解 | ||
| C. | 镁和盐酸的反应 | D. | 酸和碱的中和反应 |
 锌是一种较活泼的金属,具有广泛的用途.
锌是一种较活泼的金属,具有广泛的用途.