题目内容
18.下列物质中的离子键最强的是( )| A. | KCl | B. | CaCl2 | C. | MgO | D. | Na2O |
分析 离子晶体中离子半径越小,离子所带电荷越多,离子键越强,据此分析;
解答 解:阳离子半径:K+>Ca2+>Na+>Mg2+,阴离子半径:Cl->O2-,Ca2+、Mg2+、O2-均带2个电荷,其它离子均带1个电荷,离子晶体中离子半径越小,离子所带电荷越多,离子键越强,四种物质中MgO中的离子半径最小,电荷最多,所以MgO中离子键最强;
故选C.
点评 本题考查了决定离子键强弱的因素,题目难度不大,注意离子键与离子半径和离子所带电荷有关,注意基础知识的积累.

练习册系列答案
相关题目
8.生成1mol下列化学键,放出热量最多的是( )
| A. | H-I | B. | H-Br | C. | H-Cl | D. | H-F |
6.一定条件下,在体积恒定的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g)△H<0.下列有关说法正确的是( )
| A. | 降低温度可以加快反应速率 | |
| B. | 达到化学反应限度时,生成2mol NH3 | |
| C. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 | |
| D. | 向容器中再加入N2可加快正反应速率 |
10.有一种有机化合物,其结构简式如图: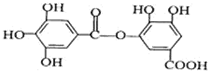 ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )
 ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )| A. | 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与6mol NaOH完全反应 | |
| C. | 在Ni催化下,1 mol 该物质可以和7mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
7.已知反应2SO2+O2?2SO3,下列判断正确的是( )
| A. | 2 mol SO2和足量O2反应,必定生成2 mol SO3 | |
| B. | 平衡时,SO2消耗速率必定等于O2生成速率的两倍 | |
| C. | 其他条件不变,增大压强,平衡必定向正反应方向移动 | |
| D. | 平衡时,SO2浓度必定等于O2浓度的两倍 |
13.下列做法不能有效改善大气质量的是( )
| A. | 大量生产、使用能过滤PM2.5的口罩 | |
| B. | 用石灰对煤燃烧后形成的烟气进行脱硫处理 | |
| C. | 开发利用太阳能、氢能、风能等清洁能源 | |
| D. | 研究廉价、高效的催化剂,以降低汽车尾气中有害物质的含量 |
 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
 锌是一种较活泼的金属,具有广泛的用途.
锌是一种较活泼的金属,具有广泛的用途.