题目内容
【题目】K3[Fe(C2O4)3]3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,可用于摄影和蓝色印刷,110℃失去结晶水,230℃分解。某化学研究小组对K3[Fe(C2O4)3]3H2O受热分解生成的气体产物和固体产物进行探究。
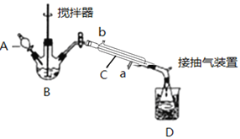
实验一:探究实验所得的气体产物,按如图装置进行实验(夹持仪器已略去,部分装置可重复使用)。
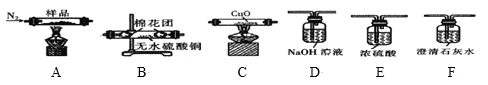
(1)实验室常用饱和NH4Cl和饱和NaNO2的混合液制N2,反应的化学方程式为__。
(2)装置的连接顺序为:A→__→__→__→__→__→F(填各装置的字母代号)。__
(3)检查装置气密性后,先通一段时间N2,其目的是__,实验结束时熄灭A、C两处的酒精灯,继续通N2至常温,其目的是__。
(4)实验过程中观察到F中的溶液变浑浊,C中有红色固体生成,则气体产物__(填化学式)。
实验二:分解产物中固体成分的探究
(5)定性实验:经检验,固体成分含有K2CO3、FeO、Fe。
定量实验:将固体产物加水溶解、过滤洗涤、干燥,得到含铁样品。完成上述实验操作,需要用到下列仪器中的___(填仪器编号)。

设计下列三种实验方案分别对该含铁样品进行含量的测定
甲方案:ag样品![]() 溶液
溶液![]() 得固体bg
得固体bg
乙方案:ag样品![]() 测得气体体积VmL(标况)
测得气体体积VmL(标况)
丙方案:ag样品![]() 250mL溶液
250mL溶液![]() 三次平均消耗0.1molL-1酸性KMnO4溶液VbmL
三次平均消耗0.1molL-1酸性KMnO4溶液VbmL
你认为以上方案中可以确定样品组成的有__方案。
(6)经测定产物中n(FeO):n(Fe)=1:1,写出K3[Fe(C2O4)3]3H2O分解的化学方程式__。
【答案】NH4Cl+NaNO2![]() N2↑+NaCl+2H2O B→F→D→E→C 排除装置的空气,防止空气中的O2和CO2干扰实验结果 防止F中溶液倒吸入C中 CO2、CO ①②⑤⑦ 甲、乙 2{K3[Fe(C2O4)3]·3H2O}
N2↑+NaCl+2H2O B→F→D→E→C 排除装置的空气,防止空气中的O2和CO2干扰实验结果 防止F中溶液倒吸入C中 CO2、CO ①②⑤⑦ 甲、乙 2{K3[Fe(C2O4)3]·3H2O}![]() 3K2CO3+FeO+Fe+5CO2↑+4CO↑+6H2O
3K2CO3+FeO+Fe+5CO2↑+4CO↑+6H2O
【解析】
实验一:实验目的是探究实验所得的气体产物,三草酸合铁酸钾晶体中含有结晶水,加热时失去结晶水,即气体产物中含有水蒸气,C2O42-中C显+3价,有可能C2O42-分解成CO2和CO,水蒸气用无水硫酸铜检验,CO2用澄清石灰水,CO先还原CuO,再检验氧化产物CO2,据此分析;
实验二:实验目的是分解产物固体成分的探究,固体产物有K2CO3、FeO和Fe,碳酸钾易溶于水,FeO和Fe难溶于水,采用溶解过滤的方法,得到FeO和Fe,需要结合铁原子守恒、得失电子守恒等进行分析;
(1)NH4Cl中N显-3价,NaNO2中N显+3价,两者反应生成N2,根据氧化还原反应中的归中规律,得出反应方程式为NH4Cl+NaNO2![]() N2↑+NaCl+2H2O;
N2↑+NaCl+2H2O;
答案:NH4Cl+NaNO2![]() N2↑+NaCl+2H2O;
N2↑+NaCl+2H2O;
(2)三草酸合铁酸钾晶体中含有结晶水,加热时容易失去结晶水,即气体产物中含有水蒸气,应用无水硫酸铜检验,后续装置可能会通过溶液,引入水蒸气,因此先检验水蒸气的存在,C2O42-中C显+3价,会产生CO2和CO,CO2应用澄清石灰水检验,CO具有还原性,先还原金属氧化物,再检验氧化产物CO2,CO2对CO的检验产生干扰,因此CO2的检验放在CO检验的前面,装置的连接顺序是A→B→F→D→E→C→F;
答案:B→F→D→E→C;
(3)装置中有空气,空气中含有CO2,干扰产物气体CO2的检验,因此先通一段时间的N2,其目的是排除装置的空气,防止空气的O2和CO2干扰实验;实验结束时,先熄灭A和C两处的酒精灯,再通入N2至室温,其目的是防止压强减小,装置D中的溶液倒吸入C中;
答案:排除装置的空气,防止空气中的O2和CO2干扰实验结果;防止F中溶液倒吸入C中;
(4)观察F中溶液变浑浊,说明实验所得气体产物中含有CO2,C中有红色固体生成,说明实验所得气体产物中含有CO;
答案:CO2、CO;
(5)碳酸钾溶于水,FeO和Fe不溶于水,因此采用溶解、过滤的方法进行分离,需要用到的下列仪器有①②⑤⑦;甲方案:ag样品溶于足量的稀硝酸中,得到硝酸铁溶液,加入足量的NaOH溶液,得到Fe(OH)3固体,灼烧后得到bgFe2O3,根据铁原子守恒,可以计算出含量;故甲方案可行;
乙方案:ag固体加入足量稀硝酸反应生成NO,利用得失电子数目守恒,可以计算出含量,故乙方案可行;
丙方案:样品与稀硝酸反应,得到硝酸铁,Fe3+不与酸性高锰酸钾溶液发生反应,不能计算出含量,故丙方案不可行;
答案:①②⑤⑦;甲、乙;
(6)根据上述分析,获得产物是K2CO3、CO2、CO、FeO、Fe、H2O,其中FeO和Fe物质的量相等,因此化学反应方程式为2{K3[Fe(C2O4)3]·3H2O}![]() 3K2CO3+FeO+Fe+5CO2↑+4CO↑+6H2O;
3K2CO3+FeO+Fe+5CO2↑+4CO↑+6H2O;
答案:2{K3[Fe(C2O4)3]·3H![]() 3K2CO3+FeO+Fe+5CO2↑+4CO↑+6H2O。
3K2CO3+FeO+Fe+5CO2↑+4CO↑+6H2O。

 教材全解字词句篇系列答案
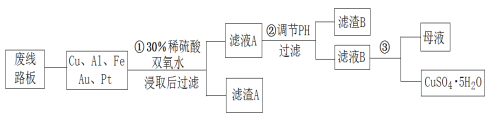
教材全解字词句篇系列答案【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。利用处理后的废旧锂离子电池材料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)制备CoO,工艺流程如图:
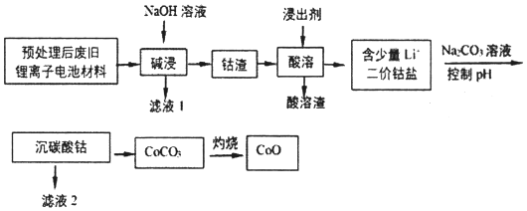
回答下列问题:
(1)Co元素在元素周期表中的位置___。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极回收的原因是___;提高“碱浸”效率的措施有____(至少写两种)。
(3)不同浸出剂“酸溶”结果如表:
出剂 | 浸出液化学成分/(gL-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCl | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
①浸出剂(a)的钴浸出率最高,而实际工艺中一般不选用浸出剂(a)的原因是____。
②温度越高浸出反应速率越快,所以“酸溶”一般选用较高的温度。据此你选择的浸出剂是___(填序号),理由是___。
③从氧化还原角度分析,还原等物质的量的Co3O4,需要___(填“H2O2”或“Na2S2O3”)物质的量更少。
④综上分析,写出最合适的浸出剂与Co3O4反应的化学方程式____。
(4)已知:Ksp[Co(OH)2]=1.0×10-15,Ksp(Li2CO3)=1.7×10-3,Ksp(CoCO3)=1.5×10-13。若滤液2中Co2+含量为5.9×10-2gL1,计算判断“沉碳酸钴”应调节pH不高于____。
【题目】利用图示实验装置可完成多种实验,其中不能达到相应实验目的的是

选项 | 试剂1、试剂2 | 实验目的 |
A | 过量锌粒、食醋溶液 | 测定食醋中醋酸浓度 |
B | 粗锌、过量稀硫酸 | 测定粗锌(含有不参与反应的杂质)纯度 |
C | 碳酸钠固体、水 | 证明碳酸钠水解吸热 |
D | 过氧化钠固体、水 | 证明过氧化钠与水反应产生气体 |
A.AB.BC.CD.D