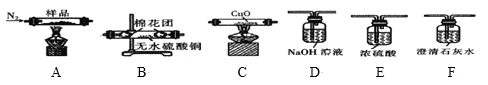
题目内容
【题目】在某密闭容器中,发生如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
A.平衡体系增加O2对反应的影响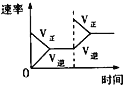
B.温度对反应的影响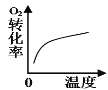
C.压强对反应的影(P1>P2)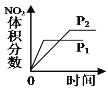
D.催化剂对反应的影响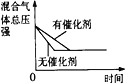
【答案】A
【解析】
A. 增大O2的量,平衡正向移动;
B. 该反应为放热反应,升高温度,平衡向放热的方向移动;
C. 增大压强,平衡向体积缩小的方向移动;
D. 加入催化剂,反应速率加快,平衡不移动。
A. 增大O2的量,平衡正向移动,图象正确,A项正确;
B. 该反应为放热反应,升高温度,平衡逆向移动,O2的转化率降低,曲线与研究目的不相符,B项错误;
C. 增大压强,反应速率加快,达到平衡所用的时间缩短,平衡正向移动,NO2的体积分数逐渐增大,曲线与研究目的不相符,C项错误;
D. 加入催化剂,反应速率加快,达到平衡所用的时间缩短,平衡不移动,曲线与研究目的不相符,D项错误;
答案选A。
改变的条件(其他条件不变) | 化学平衡移动的方向 | |||
浓度 | 增大反应物浓度或减小生成物浓度 | 向正反应方向移动 | ||
减小反应物浓度或增大生成物浓度 | 向逆反应方向移动 | |||
压强(对有气体参加的反应) | 反应前后气体体积改变 | 增大压强 | 向气体分子总数减小的方向移动 | |
减小压强 | 向气体分子总数增大的方向移动 | |||
反应前后气体体积不变 | 改变压强 | 平衡不移动 | ||
温度 | 升高温度 | 向吸热反应方向移动 | ||
降低温度 | 向放热反应方向移动 | |||
催化剂 | 同等程度改变v正、v逆,平衡不移动 | |||

 教学练新同步练习系列答案
教学练新同步练习系列答案【题目】某同学用NaOH溶液来滴定邻苯二甲酸氢钾溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是_____________________________,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是______________。
(2)选用指示剂是______________,滴定终点现象______________________________________。
(3)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
滴定次数实验数据 | 1 | 2 | 3 | 4 |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是_______________。
(4)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________(填“偏大”、“偏小”或“无影响”)。