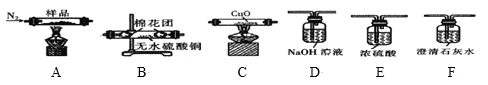
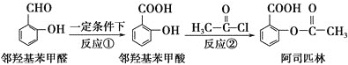
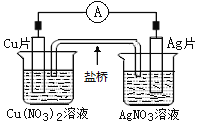
题目内容
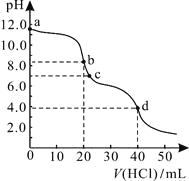
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。

下列叙述正确的是
A. 曲线N表示pOH与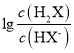 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
【答案】D
【解析】
Na2X溶液中,X2-分步水解,以第一步水解为主,则Kh1(X2-)>Kh2(X2-),碱性条件下,则pOH相同时,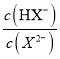 >
>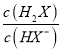 ,由图象可知N为pOH与lg
,由图象可知N为pOH与lg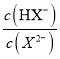 的变化曲线,M为pOH与lg
的变化曲线,M为pOH与lg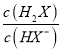 变化曲线,当lg
变化曲线,当lg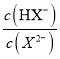 或lg
或lg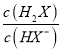 =0时,说明
=0时,说明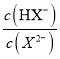 或
或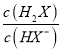 =1,浓度相等,结合图像可计算水解常数并判断溶液的酸碱性。
=1,浓度相等,结合图像可计算水解常数并判断溶液的酸碱性。
A.由以上分析可知,曲线N表示pOH与lg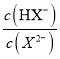 的变化曲线,故A错误;B.由曲线M可知,当lg
的变化曲线,故A错误;B.由曲线M可知,当lg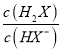 =0时,
=0时,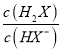 =1,pOH=9,c(OH-)=10-9mol/L,则Kh2(X2-)=
=1,pOH=9,c(OH-)=10-9mol/L,则Kh2(X2-)=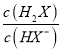 ×c(OH-)=1×10-9;由曲线N可知,当lg
×c(OH-)=1×10-9;由曲线N可知,当lg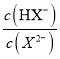 =0时,
=0时,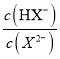 =1,pOH=4,c(OH-)=10-4mol/L,Kh1(X2-)=
=1,pOH=4,c(OH-)=10-4mol/L,Kh1(X2-)=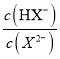 ×c(OH-)=1×10-4,则HX-的电离平衡常数Ka2=
×c(OH-)=1×10-4,则HX-的电离平衡常数Ka2=![]() =
=![]() =1×10-10,则NaHX溶液中HX-的水解程度大于电离程度,溶液中c(H2X)>c( X2-),故B错误;C.混合液中存在电荷守恒式为c(Na+)+ c(H+)=c(Cl-)+c(HX-)+2c(X2-)+c(OH-),则当混合溶液呈中性时,c(Na+)=c(Cl-)+c(HX-)+2c(X2-),故C错误;D.由曲线N可知,当lg
=1×10-10,则NaHX溶液中HX-的水解程度大于电离程度,溶液中c(H2X)>c( X2-),故B错误;C.混合液中存在电荷守恒式为c(Na+)+ c(H+)=c(Cl-)+c(HX-)+2c(X2-)+c(OH-),则当混合溶液呈中性时,c(Na+)=c(Cl-)+c(HX-)+2c(X2-),故C错误;D.由曲线N可知,当lg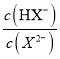 =0时,
=0时,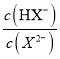 =1,pOH=4,c(OH-)=10-4mol/L,则Kh1(X2-)=
=1,pOH=4,c(OH-)=10-4mol/L,则Kh1(X2-)=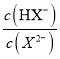 ×c(OH-)=1×10-4,故D正确;故答案为D。
×c(OH-)=1×10-4,故D正确;故答案为D。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】某同学用NaOH溶液来滴定邻苯二甲酸氢钾溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是_____________________________,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是______________。
(2)选用指示剂是______________,滴定终点现象______________________________________。
(3)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
滴定次数实验数据 | 1 | 2 | 3 | 4 |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是_______________。
(4)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________(填“偏大”、“偏小”或“无影响”)。