题目内容
【题目】过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒、禽流感病毒)、细菌、真菌及芽孢。下面是市售过氧乙酸商品标签:

有关资料:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂。过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH)。CH3COOOH容易放出氧原子,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
(1)某研究性学习小组为了弄清配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?进行以下科学探究,请你完成下列相关内容:
①提出假设:甲溶液的主要成分为_________,乙溶液的主要成分为_________。
②实验验证:取甲、乙两种溶液少许,分别加入几滴_________试液,若①中假设正确,则甲溶液的现象为_____________________,乙溶液的现象为__________。
(2)有关过氧乙酸的叙述正确的是_________ (填编号)
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸与苯酚混合使用可增强消毒效果
C.过氧乙酸与乙酸属于同系物
D.氧元素的化合价为-2价
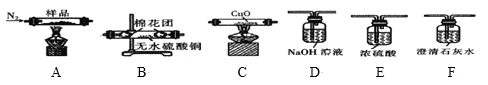
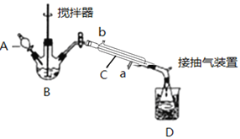
(3)实验室制备少量过氧乙酸,可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃至反应结束。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。
请回答下列问题:
①仪器C的名称是_______________;
②为更好地控制反应温度,应采用方法是_________________;
③生成过氧乙酸的化学方程式为________________________________________;
④碘量法取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KMnO4溶液至恰好粉红色以除去残余H2O2,再加入10mL 10%KI溶液和几滴淀粉溶液,摇匀,反应完全后再用0.1000mol/L的Na2S2O3标准液滴定至终点(反应方程式为2Na2S2O3+I2=Na2S4O6+2NaI),共消耗14.30mL Na2S2O3标准液。该样品中过氧乙酸的物质的量浓度是_____mol/L。(结果保留小数点后两位)(提示:CH3COOOH+2I+2H+ =I2+CH3COOH +H2O)
【答案】甲H2O2、H2O、H2SO4 乙CH3COOH 、 H2O 石蕊 甲:溶液先变红后褪色 乙:溶液由无色变为红色 A 冷凝管(或直形冷凝管) 水浴加热 CH3COOH + H2O2→CH3COOOH + H2O 7.15
【解析】
(1)若假设甲溶液的有效成分是H2O2,则乙溶液的有效成分是CH3COOOH,根据过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH),H2O2是极弱的电解质,在酸性介质中才能稳定存在,则H2SO4应该在甲溶液中,另外两种溶液中的水也是一种主要成分;两溶液都呈酸性,都能使紫色石蕊试液变红,但是甲溶液中H2O2漂白作用的会使变红的溶液褪色;
(2)结合选项对过氧乙酸(CH3COOOH)性质判断,
(3)①由仪器的结构,可知C为直形冷凝管;
②控制B中混合液的温度为20~30℃,应采取水浴加热;
③结合题中信息,写出生成过氧乙酸的化学反应方程式;
CH3COOOH+2I+2H+ =I2+CH3COOH +H2O,2Na2S2O3+I2=Na2S4O6+2NaI,由这两个方程式,确定关系式:CH3COOOH~I2~2Na2S2O3,计算稀释后5.00mL溶液中过氧乙酸的物质的量,再计算原来的2.00mL溶液中的过氧乙酸的物质的量,再根据物质的量浓度定义式计算。
(1)若假设甲溶液的有效成分是H2O2,则乙溶液的有效成分是CH3COOOH,根据过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH),H2O2是极弱的电解质,在酸性介质中才能稳定存在,则H2SO4应该在甲溶液中,另外两种溶液中的水更是一种主要成分;两溶液都呈酸性,都能使紫色石蕊试液变红,但是甲溶液中H2O2漂白作用的会使变红的溶液褪色;
(2)过氧乙酸与羟基乙酸(HOCH2COOH)的分子式都是C2H4O3,但结构不同,故互为同分异构体;过氧乙酸具有强氧化性,而苯酚易被氧化,两者混合发生氧化还原反应,不能增强消毒效果;过氧乙酸的分子结构中存在过氧根而乙酸中没有,两者结构不相似,不属于同系物;过氧乙酸中的氧元素有+2价、+1价;
(3)①由仪器的结构,可知C为直形冷凝管;
②控制B中混合液的温度为20~30℃,应采取水浴加热,受热均匀,便于控制温度;
③乙酸与过氧化氢在浓硫酸、20~30℃条件下反应生成过氧乙酸(CH3COOOH),反应的化学方程式为:CH3COOH + H2O2![]() CH3COOOH + H2O ;
CH3COOOH + H2O ;
④CH3COOOH+2I+2H+ =I2+CH3COOH +H2O,2Na2S2O3+I2=Na2S4O6+2NaI,由这两个方程式,确定关系式:CH3COOOH~I2~2Na2S2O3,可知稀释后的5.00mL溶液中过氧乙酸的物质的量是:![]() ×0.0143L×0.1000mol/L,原来2.00mL溶液中的过氧乙酸的物质的量是:
×0.0143L×0.1000mol/L,原来2.00mL溶液中的过氧乙酸的物质的量是:![]() ×0.0143L×0.1000mol/L×
×0.0143L×0.1000mol/L×![]() =0.0143mol,该该样品中过氧乙酸的物质的量浓度是:
=0.0143mol,该该样品中过氧乙酸的物质的量浓度是:![]() =7.15 mol/L 。
=7.15 mol/L 。