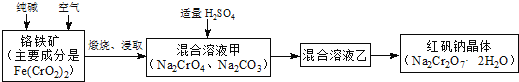
题目内容
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。利用处理后的废旧锂离子电池材料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)制备CoO,工艺流程如图:
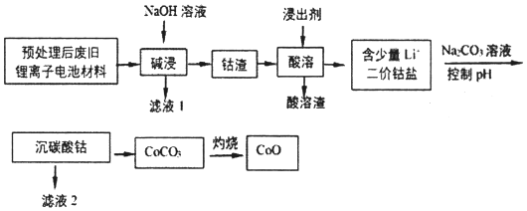
回答下列问题:
(1)Co元素在元素周期表中的位置___。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极回收的原因是___;提高“碱浸”效率的措施有____(至少写两种)。
(3)不同浸出剂“酸溶”结果如表:
出剂 | 浸出液化学成分/(gL-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCl | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
①浸出剂(a)的钴浸出率最高,而实际工艺中一般不选用浸出剂(a)的原因是____。
②温度越高浸出反应速率越快,所以“酸溶”一般选用较高的温度。据此你选择的浸出剂是___(填序号),理由是___。
③从氧化还原角度分析,还原等物质的量的Co3O4,需要___(填“H2O2”或“Na2S2O3”)物质的量更少。
④综上分析,写出最合适的浸出剂与Co3O4反应的化学方程式____。
(4)已知:Ksp[Co(OH)2]=1.0×10-15,Ksp(Li2CO3)=1.7×10-3,Ksp(CoCO3)=1.5×10-13。若滤液2中Co2+含量为5.9×10-2gL1,计算判断“沉碳酸钴”应调节pH不高于____。
【答案】第四周期第VIII族 放电有利于Li+向正极移动并进入正极材料 粉碎、适当增大NaOH溶液的浓度(或适当升高温度等) 有Cl2生成,污染空气 (c) Co3O4能氧化Cl-,生成有污染性的氯气,而Na2S2O3在溶液中受热影响小,因此选择(c)效果优于前者 Na2S2O3 4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O 8.0
【解析】
(1)Co原子序数是27,根据原子结构推断其在周期表的位置;
(2)原电池放电时,阳离子由负极移向正极,提高浸取率的措施有固体粉碎、玻璃棒搅拌、适当升高浸取液的温度和增大浸取液的浓度、延长浸取时间等;
(3)废料用碱液溶解,过滤得到滤液①偏铝酸钠溶液和钴渣;用H2SO4、Na2S2O3溶解钴渣,发生的反应为4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,得到含有钴离子的溶液,然后调节溶液pH并用碳酸钠溶液将钴离子转化成碳酸钴沉淀,过滤得到碳酸钴沉淀,灼烧碳酸钴得到氧化钴,据此分析解答;
(4)先求出c(Co2+),再根据KspCo(OH)2=c(Co2+)×c2(OH-)=1.0×10-15进行计算。
(1)Co原子序数是27,核外电子排布式为[Ar]3d74s2,位于第四周期第VIII族,故答案为:第四周期第VIII族;
(2)原电池放电时,电解质溶液中阳离子由负极移向正极,所以废旧锂离子电池拆解前进行“放电处理”有利于Li+向正极移动并进入正极材料;提高浸取率的措施有固体粉碎、玻璃棒搅拌、适当升高浸取液的温度和增大浸取液的浓度等,故答案为:放电有利于Li+向正极移动并进入正极材料;粉碎、适当增大NaOH溶液的浓度(或适当升高温度等);
(3)①因Co3O4有较强氧化性,能氧化溶液里的Cl-,生成的氯气对环境有污染,发生反应的离子方程式为Co3O4+2Cl-+8H+=3Co2++Cl2↑+4H2O,故答案为:有Cl2生成,污染空气;
②根据表中不同浸出剂“酸溶”实验结果可知,使用HCl或H2SO4+Na2S2O3时浸出液化学成分中Co的含量高、钴浸出率也较高,Co3O4有较强氧化性,在酸性条件下氧化S2O32-生成SO42-,但Co3O4也能氧化Cl-,生成有污染性的氯气,不符合绿色化学理念,所以综合考虑应选择的浸出剂是H2SO4+Na2S2O3,即(c),故答案为:(c);Co3O4能氧化Cl-,生成有污染性的氯气,而Na2S2O3在溶液中受热影响小,因此选择(c)效果优于前者;
③Co3O4~Co2+~2e-,H2O2~O2~2e-,Na2S2O3~2Na2SO4~4e-,若还原1molCo3O4,则转移电子2mol,被氧化的H2O2的物质的量为1mol、被氧化的Na2S2O3的物质的量为0.5mol,所以还原等物质的量的Co3O4,需要Na2S2O3的物质的量更少,故答案为:Na2S2O3;
④综上考虑,最合适的浸出剂为H2SO4+Na2S2O3,根据电子守恒和原子守恒配平、写出的反应的化学方程式4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,故答案为:4Co3O4+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;
(4)若滤液2中含Co2+为5.9×10-2gL-1,c(Co2+)=![]() L1=10-3mol/L,且Ksp[Co(OH)2]=c(Co2+)×c2(OH-)=1.0×10-15,则恰好转化为Co(OH)2时溶液中c(OH-)=
L1=10-3mol/L,且Ksp[Co(OH)2]=c(Co2+)×c2(OH-)=1.0×10-15,则恰好转化为Co(OH)2时溶液中c(OH-)=![]() mol/L=10-6mol/L,c(H+)=10-8mol/L,此时溶液pH=8.0,即“沉碳酸钴“应控制pH不高于8.0,故答案为:8.0。
mol/L=10-6mol/L,c(H+)=10-8mol/L,此时溶液pH=8.0,即“沉碳酸钴“应控制pH不高于8.0,故答案为:8.0。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
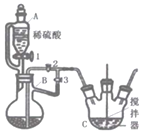
开心蛙口算题卡系列答案【题目】实验室用图所示装置制备KClO溶液,并通过KClO溶液与![]() 溶液的反应制备高效水处理剂
溶液的反应制备高效水处理剂![]() 已知
已知![]() 具有下列性质
具有下列性质![]() 可溶于水、微溶于浓KOH溶液,
可溶于水、微溶于浓KOH溶液,![]() 在
在![]() 、强碱性溶液中比较稳定,
、强碱性溶液中比较稳定,![]() 在
在![]() 和
和![]() 催化作用下发生分解,
催化作用下发生分解,![]() 在酸性至弱碱性条件下,能与水反应生成
在酸性至弱碱性条件下,能与水反应生成![]() 和
和![]() 。
。
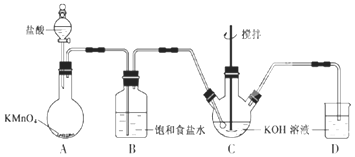
(1)装置A中![]() 与盐酸反应生成
与盐酸反应生成![]() 和
和![]() ,其化学方程式为______,装置B的作用是______。
,其化学方程式为______,装置B的作用是______。
(2)![]() 和KOH在较高温度下反应生成
和KOH在较高温度下反应生成![]() ,试写出该反应的离子方程式______。
,试写出该反应的离子方程式______。
(3)制备![]() 时,KClO饱和溶液与
时,KClO饱和溶液与![]() 饱和溶液的混合方式为:在搅拌下,将
饱和溶液的混合方式为:在搅拌下,将![]() 饱和溶液缓慢滴加到KClO饱和溶液中。理由是______。
饱和溶液缓慢滴加到KClO饱和溶液中。理由是______。
(4)已知![]() 时
时![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 下表列出了几种离子生成氢氧化物沉淀的
下表列出了几种离子生成氢氧化物沉淀的![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() 。
。
开始沉淀的pH | 沉淀完全的pH | |
|
|
|
|
|
|
|
|
|
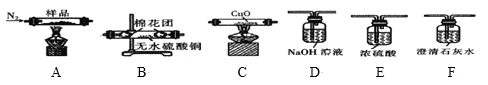
实验中可选用的试剂:![]() 、
、![]() 、
、![]() 由某硫酸锌溶液
由某硫酸锌溶液![]() 含
含![]() 、
、![]() 杂质
杂质![]() 制备ZnO的实验步骤依次为:
制备ZnO的实验步骤依次为:
![]() ______;
______;
![]() ______;
______;
![]() 过滤;
过滤;
![]() ______;
______;
![]() 过滤、洗涤、干燥;
过滤、洗涤、干燥;
![]() 煅烧。
煅烧。