题目内容
4. 高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.(1)Ni2+基态核外电子排布式为1s22s22p63s23p63d8.
(2)ClO4-的空间构型是正四面体;与ClO4-互为等电子体的一种分子为CCl4等(填化学式).
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为sp2;1molCO(N2H3)2分子中含有σ键数目为11×6.02×1023.
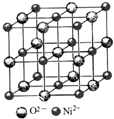
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成.NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a:b:c=2:3:6.
分析 (1)Ni元素原子核外有28个电子,原子核外电子排布为1s22s22p63s23p63d84s2,Ni失去4s能级2个电子形成Ni2+;
(2)计算Cl原子价层电子对数、孤电子对,进而确定ClO4-的空间构型;
原子总数相同、价电子总数相同的微粒互为等电子体;
(3)CO(N2H3)2中C原子与O原子之间形成双键,与N原子之间形成C-N单键,没有孤对电子,据此确定杂化轨道数目,进而确定杂化方式,-N2H3中氮原子之间形成N-N单键,N原子与H原子之间形成N-H单键;
(4)Ni2+离子位于晶胞顶点及面心,可以均摊法计算晶胞中Ni2+数目,以顶点Ni2+离子研究,与之最近的O2-离子位于棱中间且关于Ni2+离子对称,与之最近的Ni2+离子位于面心,每个顶点为12个面共用.
解答 解:(1)Ni元素原子核外有28个电子,原子核外电子排布为1s22s22p63s23p63d84s2,Ni失去4s能级2个电子形成Ni2+,Ni2+离子核外电子排布式为:1s22s22p63s23p63d8,
故答案为:1s22s22p63s23p63d8;
(2)ClO4-中氯原子价层电子对数为4+$\frac{7+1-2×4}{2}$=4、没有孤电子对,故其空间构型是:正四面体;
原子总数相同、价电子总数相同的微粒互为等电子体,与ClO4-互为等电子体的一种分子为CCl4等,
故答案为:正四面体;CCl4等;
(3)CO(N2H3)2中C原子与O原子之间形成双键,与N原子之间形成C-N单键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,-N2H3中氮原子之间形成N-N单键,N原子与H原子之间形成N-H单键,分子中含有11个σ键,故1molCO(N2H3)2分子中含有σ键数目为11×6.02×1023,
故答案为:sp2;11×6.02×1023;
(4)①Ni2+离子位于晶胞顶点及面心,晶胞中Ni2+数目x=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,以顶点Ni2+离子研究,与之最近的O2-离子位于棱中间且关于Ni2+离子对称,故Ni2+的配位数y=6,与之最近的Ni2+离子位于面心,每个顶点为12个面共用,与之距离最近的镍离子数目z=12,故x:y:z=4:6:12=2:3:6,
故答案为:2:3:6.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道、微粒空间构型、化学键、晶胞计算等,需要学生具备扎实的基础,具有一定的空间想象,难度中等.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | 物质的量浓度相等的HA和NaA溶液等体积混合,溶液呈碱性:c(A-)<c(HA) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | pH=3的HCl和pH=11的氨水等体积混合后:c(Cl-)>c(NH4+) | |
| D. | 1.0mol/L Na2CO3溶液:2c(CO32-)+c(HCO3-)+c(OH-)-c(H+)=2.0mol/L |
| A. |  用于制氨气并收集干燥的氨气 | |
| B. |  是实现化学能转化为电能的铜锌原电池的原理示意图 | |
| C. | 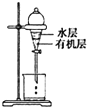 是用CCl4提取碘水中的I2 | |
| D. |  用于配制100mL0.2mo1•L-1的硫酸溶液 |
| A. | H2O是一种弱电解质 | B. | CO2是一种温室气体 | ||
| C. | HCOOH是一种一元弱酸 | D. | 该研究中能量转化方式只有1种 |
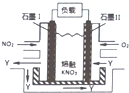 NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )
NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )| A. | NO2在石墨I附近发生氧化反应 | |
| B. | 该电池放电时N03-向石墨I电极迁移 | |
| C. | 石墨Ⅱ附近发生的反应:O2+4e-+2N205=4 N03- | |
| D. | 相同条件下,放电过程中消耗的NO2和O2的体积比为l:4 |
| A. | 18gH218O含有l0NA个质子 | |
| B. | 过量铁粉在氯气中燃烧生成FeCl2 | |
| C. | 0.1mol•L-1NaAlO2溶液中可以大量存在:HCO3-、NH4+、SO42-、Fe3+ | |
| D. | 在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明ksp(CuS)远小于Ksp(FeS) |
 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
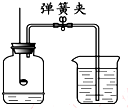 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )| A. | 实验时红磷一定过量 | |
| B. | 点燃红磷前先用弹簧夹夹紧乳胶管 | |
| C. | 红磷熄灭后立刻打开弹簧夹 | |
| D. | 最终进入瓶中水的体积约为氧气的体积 |
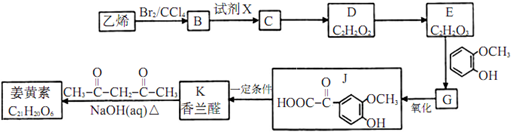

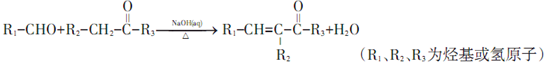
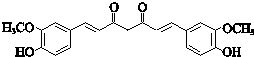 ;
;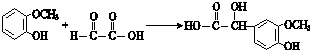 ;其反应类型是加成反应;
;其反应类型是加成反应;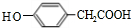 (写结构简式).
(写结构简式).