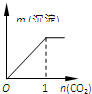
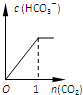
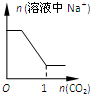
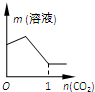
题目内容
5. 实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )| A. | a为电源正极 | B. | 电极Ⅱ上发生还原反应 | ||
| C. | 电子流向:a→Ⅰ→Ⅱ→b | D. | 该装置将电能转化为化学能 |
分析 电解氯化铜溶液时,连接电源负极的电极是阴极,阴极上铜离子得电子析出铜单质,所以Ⅰ为阴极,a为负极;连接电源正极的电极是阳极,阳极上氯离子失电子生成氯气,所以,Ⅱ为阳极,b为负极,据此分析.
解答 解:A、a为电源的负极,故A错误;
B、Ⅱ为阳极,阳极上发生氧化反应,故B错误;
C、电子不能通过电解质溶液,电子流向为Ⅱ→b→a→Ⅰ,故C错误;
D、电解池是电能转化为化学能的装置,故D正确;
故选D.
点评 本题考查了电解池原理,难度不大,明确溶液中离子的放电顺序是解本题的关键.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
15.下列实验装置正确并能达到实验目的是( )
| A. |  用于制氨气并收集干燥的氨气 | |
| B. | 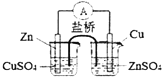 是实现化学能转化为电能的铜锌原电池的原理示意图 | |
| C. | 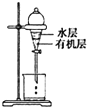 是用CCl4提取碘水中的I2 | |
| D. |  用于配制100mL0.2mo1•L-1的硫酸溶液 |
16.下列说法正确的是( )
| A. | 18gH218O含有l0NA个质子 | |
| B. | 过量铁粉在氯气中燃烧生成FeCl2 | |
| C. | 0.1mol•L-1NaAlO2溶液中可以大量存在:HCO3-、NH4+、SO42-、Fe3+ | |
| D. | 在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明ksp(CuS)远小于Ksp(FeS) |
13. 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
20.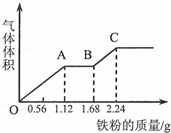 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )| A. | 原混合酸溶液的pH=0,c(H2SO4)=0.1mol•L-1 | |
| B. | OA段的反应为:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | AB段的反应为:Fe+2Fe3+═3Fe2+ | |
| D. | BC段气体产物为氢气 |
17.一定体积某浓度的SnC12溶液与过量FeC13溶液充分混合后,再用0.2000mol/l K2Cr2O7标准溶液滴定.若所需K2Cr2O7溶液的体积恰好是SnCl2溶液的一半,则c(SnC12)为( )
| A. | 0.3000 mol/L | B. | 1.2000 mol/L | C. | 0.0333 mol/L | D. | 0.1333 mol/L |
14.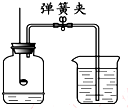 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )
 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列说法中,不正确的是( )| A. | 实验时红磷一定过量 | |
| B. | 点燃红磷前先用弹簧夹夹紧乳胶管 | |
| C. | 红磷熄灭后立刻打开弹簧夹 | |
| D. | 最终进入瓶中水的体积约为氧气的体积 |
15.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 醋酸 | Na2CO3 | Na2SiO3 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |